بیماری ترومبوفیلی (Thrombophilia disease)
بیماری ترومبوفیلی چیست؟ ترومبوفیلی به دسته از بیماری ها گفته می شود که در آنها خون تمایل بالایی به لخته شدن دارد. این بیماری چندعاملی (multifactorial) هم می تواند به شکل وراثتی و هم اکتسابی در فرد ایجاد شده باشد. برخی عوامل ژنتیکی مانند جهش فاکتور V لیدن (factor V Leiden mutation)، کمبود آنتی ترومبین III، پروتئین C و یا S، کمبود گلیکوپروتئین غنی از هیستیدین و ترومبوفیلی مرتبط با پروترومبین می توانند منجر به بروز بیماری ترومبوفیلی در فرد مبتلا شوند. از جمله بیماری هایی که می توانند منجر به بروز این اختلال در فرد شوند (حالت اکتسابی) می توان به مواردی از جمله ترومبوسیتوپنی ناشی از هپارین (heparin induced thrombocytopenia)، سندرم antiphospholipid antibody، نئوپلازی، استفاده از داروهای ضد بارداری خوراکی، چاقی، استعمال دخانیات و انجام عمل جراحی اشاره کرد. دیگر فاکتورها و عوامل خطری که ریسک بروز ترومبوفیلی را در افراد مختلف افزایش می دهند عبارتند از:
• بارداری
• ابتلا به سرطان، انواع دیابت، مشکلات قلبی
• آلودگی فرد به وبروس HIV
• به تحرکی فرد به مدت طولانی
• اضافه وزن و چاقی
• دریافت داروهای هورمونی دارای استروژن
• بالا رفتن سن
• داشتن سابقه خانوادگی در زمینه لخته شدن خون
به طور کلی، ترومبوفیلی با ریسک ترومبوز وریدی عمقی (deep venous thrombosis) و یا ترومبوآمبولیسم وریدی (venous thromboembolism) همراه است که گاهی اوقات ترومبوز در مکان های غیرمتداول مانند عروق شبکیه و عروق مغزی رخ می دهد. ترومبوز به اختلالی گفته می شود که در آن لخته خون عروق بدن را مسدود کرده و علائم مختلفی مانند تورم و درد پاها، احساس درد در ناحیه قفسه سینه و بی حسی یک سمت از بدن را در فرد ایجاد می کند.
علائم ترومبوفیلی
نشانه های ترومبوفیلی در افراد مختلف متفاوت است و به اندازه لخته تشکیل شده، موقعیت آن و اختلالاتی که ایجاد می کند بستگی دارد. لخته های خون اغلب در عروق کوچک بدن به خصوص در اندام هایی مانند ریه ها، مغز، دست ها و پاها تشکیل می شوند، این امر منجر به بروز علائم ترومبوفیلی در فرد می گردد که عبارتند از:
• تشکیل لخته در ریه ها و آمبولی
←درد شدید در قفسه سینه و اطراف آن
←مشکلات تنفسی ناگهانی در زمان انجام فعالیت های بدنی و یا استراحت
• تشکیل لخته در قلب و حمله قلبی
←آنژین یا احساس درد در قفسه سینه
←سرگیجه
←غش کردن
←مشکلات تنفسی
• تشکیل لخته در مغز و یا گردن
←سکته مغزی (Transient ischemic attack (TIA))
←نامفهوم صحبت کردن
←احساس ضعف و یا ناتوانی در کنترل عضلات یک طرف بدن
• تشکیل لخته در شکم و ایجاد Mesenteric ischemia
←حالت تهوع و استفراغ
←احساس درد در ناحیه شکم و معده به خصوص بعد از صرف غذا
←اسهال خونی
←داشتن تب
←نفخ
• تشکیل لخته در دستان و پاها
←احساس درد در ناحیه تشکیل لخته
←تورم به دلیل تجمع مایعات
←سوزن سوزن شدن یا بی حسی با درد
←تاول زدن یا ایجاد زخم
انواع ترومبوفیلی و علت بروز آنها
بیماری ترومبوفیلی انواع مختلفی دارد که در ادامه به معرفی شایع ترین آنها پرداخته می شود.
• فاکتور V لیدن
این حالت شایع ترین نوع بیماری ترومبوفیلی اشت. فاکتور V لیدن (FVL) یک اختلال ژنتیکی لخته شدن خون است که به وسیله پاسخ ضد انعقادی ضعیف به APC مشخص می شود. APC یک پروتئین طبیعی ضدانعقادی است که عملکرد آن شکست فاکتورهای پیش انعقادی Va و VIII و غیر فعال کردن آنها می باشد و در نتیجه باعث کاهش تولید ترومبین می گردد. فاکتور V لیدن با برش فاکتور Va از سه ناحیه مختلف دارای آرژنین (R 306، R 506 و R 679) آن را غیر فعال می کند.
← علت
اصطلاح فاکتور V لیدن نام یک جهش ژنی خاص است که باعث جایگزینی آمینواسید گوانین با آدنین در موقعیت 1691 در ژن فاکتور V یا F5 شده و در نتیجه آن نسبت به APC مقاومت پیدا می کند. افرادی که دارای این جهش هستند تمایل به تشکیل نوعی لخته خونی به نام ترومبوز وریدی عمقی (DVT) در آنها بالاتر است که می تواند منجر به انسداد عروق خونی گردد.
زنانی که دارای این نوع جهش هستند در معرض خطر بیشتری برای سقط جنین مکرر و یا سقط در سه ماهه دوم یا سوم قرار دارند. نتایج گزارش شده از برخی تحقیقات نشان می دهند که جهش فاکتور V لیدن ممکن است خطر سایر عوارض در دوران بارداری از جمله فشار خون بالا (پره اکلامپسی) ناشی از بارداری، رشد آهسته جنین و جدا شدن زود هنگام جفت از دیواره رحم را افزایش دهد. با این حال، ارتباط بین جهش FVL و این عوارض تایید نشده و اکثر زنان مبتلا به ترومبوفیلی FVL حاملگی طبیعی دارند.
الگوی توارث این جهش اتوزومی غالب بوده و فراوانی جهش هتروزیگوس بیشتر از نوع هموزیگوس آن است. تشخیص این جهش به دو روش تعیین ژنوتایپ مبتنی بر تکثیر DNA و آزمایش بررسی عملکردی مقاوت FVL به APC یا APC-R امکان پذیر می باشد. در حال حاضر بیشتر آزمایشگاه های مولکولی از طریق تکثیر DNA ژنومی با استفاده از روش های مبتنی بر PCR و روش های متعاقب مانند تعیین ژنوتایپ و هیبریداسیون با استفاده از پروب به تشخیص این جهش می پردازند.
با وجود اینکه آزمایش های DNA دقیق تر و حساس تر هستند باز هم بعضی از آزمایشگاه ها از آزمایش عملکردی APC-R استفاده کرده و در صورت مشاهده نتایج غیرطبیعی، جهت تایید نتایج آزمایش DNA را انجام می دهند. آزمایش APC-R مقرون به صرفه تر است و می تواند مقاوت به APC ناشی از سایر عوامل (به جز جهش) را نیز تشخیص دهد. هر چند در مواردی مانند بیماری لوپوس و وجود سابقه ترومبوفیلی در خویشاوندان روش های مبتنی بر DNA پیشنهاد می شود.
← نام های دیگر این بیماری
• APC resistance, Leiden type
• Hereditary resistance to activated protein C
• کمبود پروتئین C
پروتئین C و S انواعی از گلیکوپروتئین های وابسته به ویتامین K هستند که در کبد سنتز می شوند. شکل فعال پروتئین C یا APC (Activated form of Protein C) یک ضدانعقاد خون طبیعی است که به همراه کوفاکتور PS تولید ترومبین را به وسیله مهار فاکتورهای Va و VIIIa کاهش می دهد. جهش پروتئین C یک بیماری نادر ژنتیکی است که می تواند عامل تشکیل لخته های کوچک در بدن شود.
← علت
جهش مرتبط با این نوع از بیماری ترومبوفیلی در ژن PROC رخ می دهد که می تواند به دو شکل خفیف با الگوی توارث اتوزوم غالب و یا شدید با الگوی توارث اتوزوم مغلوب مشاهده شود. در حالت خفیف تنها یکی از دو ژن PROC دچار جهش می شود در حالی در حالت شدید هر دو ژن دچار جهش می گردند.
← نام های دیگر این بیماری
• Hereditary thrombophilia due to protein C deficiency
• PROC deficiency
• کمبود پروتئین S
کمبود پروتئین S نوعی اختلال ارثی است که نقش پیچیده ای در فرآیندهای انعقاد خون، التهاب و آپوپتوز ایفا می کند. این پروتئین نوعی سرین پروتئاز است که باعث تسهیل عملکرد پروتئین فعال C یا APC بر روی فاکتور های F5a و F8a می گردد و بروز نقص در آن عمل ایجاد لخته های خونی در عروق می باشد.
← علت
این نقص به دلیل بروز جهش در ژن PROS1 که کد کننده پروتئین s می باشد، رخ می دهد. افرادی که دارای جهش در یکی از ژن های PROS1 هستند به نوع ملایم آن مبتلا شده و اگر جهش در هردو ژن رخ دهد علائم بیماری حاد خواهد بود. الگوی توارث این بیماری به شکل اتوزوم غالب می باشد.
← نام های دیگر این بیماری
• Hereditary thrombophilia due to protein S deficiency
• جهش ژن پروترومبین
پروترومبین (فاکتور II) پیش ساز ترومبین در در مسیر انعقاد خون می باشد. این پروتئین دارای فعالیت های مختلفی از جمله ضد انعقاد خون (anticoagulant)، ضد فیبرینولیتیک (antifibrinolytic) و پیش انعقادی (procoagulant) است که بروز جهش در ژن کد کننده این پروتئین می تواند عامل بروز چندین مشکل و عدم تعادل در مسیر هموستاز گردد.
← علت
جهش G20210A در ناحیه 3′ UTR ژن پروترومبین، از جمله مهم ترین جهش هایی است که در این ژن مشاهده شده و با افزایش خطر بروز ترومبوز وریدی عمقی همراه است. پس از فاکتور V لیدن، جهش PGM دومین جهش رایج در ایجاد ترومبوفیلی ارثی است؛ این جهش به صورت جهش نقطه ای (G˃A) در قسمت non-coding ژن و در موقعیت 20210 اتفاق می افتد. این جهش باعث افزایش بیان ژن و متعاقبا افزایش میزان پروتئین پروتومبین می شود. این افزایش حدود 25-30 درصد در حالت هتروزیگوت و 60-70 درصد در حالت هموزیگوت است. پروتورومبین عامل اصلی تولید ترومبین است و افزایش ترومبین باعث افزایش ریسک ترومبوز می شود. الگوی وراثتی جهش PGM اتوزومی غالب است و نوع هتروزیگوس آن بسیار فراوان تر از حالت هموزیگوس است. جهش PGM با کمک روش های تعیین ژنوتایپ DNA مبتنی بر واکنش PCR امکان پذیر است.
← نام های دیگر این بیماری
• Hyperprothrombinemia
• Prothrombin G20210A Thrombophilia
• سندرم آنتی فسفولیپید
سندرم آنتی فسفولیپید (APS) یا Hughes syndrome، یک بیماری ژنتیکی مرتبط با سیستم ایمنی است که منجر به افزایش خطر ایجاد لخته خون در عروق می گردد. در این بیماری سیستم ایمنی آنتی بادی های غیر طبیعی به نام آنتی بادی های آنتی فسفولیپید تولید می کند. این پروتئین ها به مولکول های چربی یا فسفولیپیدها متصل شده و احتمال لخته شدن خون را افزایش میدهند.
زنان مبتلا به این سندرم در معرض خطر بیشتری برای عوارض دوران بارداری از جمله فشار خون بالا (پره اکلامپسی)، نارسایی جفت، زایمان زودرس و یا سقط جنین قرار دارند. از مهم ترین عوارض ابتلا به سندرم فسفولیپید می توان به کاهش پلاکت ها (ترومبوسیتوپنی)، کمبود گلبول های قرمز و همولیز زودرس آنها اشاره کرد. ابتلا به سندرم فسفولیپید یکی از عواملی است که در بروز ترومبوز موثر بوده و خون رسانی به بافت ها را دچار اختلال می کند. بیشتر افرادی که دارای سندرم آنتی فسفولیپید هستند به سایر بیماری های خودایمنی به خصوص لوپوس نیز مبتلا می شوند.
← علت
علت دقیق بروز این بیماری مشخص نمی باشد.
← نام های دیگر این بیماری
• Anti-phospholipid syndrome
• Antiphospholipid antibody syndrome
• Hughes syndrome
روش های تشخیص ترومبوفیلی
امروزه روش های مولکولی متعددی مبتنی بر تکثیر DNA و بر پایه واکنش PCR برای تشخیص بیماری ترومبوفیلی و جهش های FVL و PMG در دسترس هستند. این روش ها نیازمند به استخراج DNA، آنزیم های محدود کننده، الکتروفورز ژل آگارز و یا آکریل آمید، پروب های فلورسنت، کپیلاری الکتروفورز و آنالیزهای Real Time می باشند. در ادامه به معرفی روش های متداول در زمینه تشخیص ترومبوفیلی می پردازیم که عبارتند از:
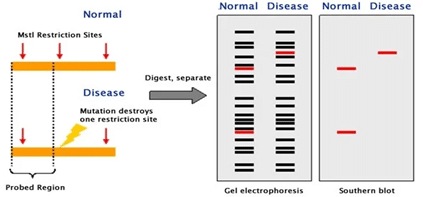
• RFLP
روش اصلی تشخیص هر یک از جهش های FVL و PMG استفاده از تکنیک Restriction Fragment Length Polymorphism (RFLP) است که در این روش DNA با استفاده از واکنش PCR تکثیر شده و سپس با آنزیم محدود کننده قطعات تکثیر یافته مورد هضم آنزیمی قرار می گیرند. در نهایت نتایج به صورت باند هایی با اندازه متفاوت در الکتروفورز ژل آگارز تفکیک می شوند و امکان متمایز کردن جهش های هتروزیگوس، هموزیگوس و آلل های طبیعی وجود دارد. کارایی RFLP با انجام آن به صورت مالتیپلکس و بررسی همزمان دو یا تعداد بیشتر جهش ها یک در تیوب افزایش می یابد.
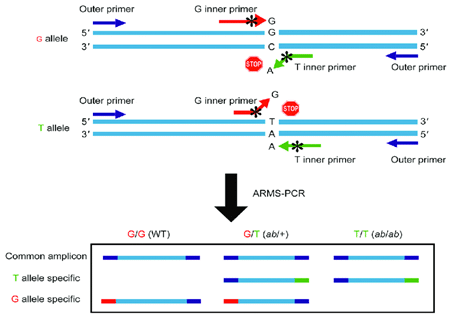
• ARMS-PCR
از دیگر روش های کاربردی در بحث تشخیص ترومبوفیلی می توان به تکنیک ARMS-PCR (Amplification-Refractory Mutation System) اشاره کرد که امروزه از دقیق ترین ابزارها در زمینه تشخیص بیماری های ژنتیکی می باشد. این روش در تشخیص جهش های تک نوکلئوتیدی (SNP) و یا حذف های کوچک مورد استفاده قرار می گیرد. اساس این روش استفاده از پرایمرهای PCR مختص یک توالی خاص با اتصال دقیق انتهای ‘ 3 پرایمر به رشته الگو به منظور تکثیر با PCR است. تکثیر قطعه مدنظر زمانی در این روش انجام خواهد شد که آلل با توالی هدف در ژنوم حضور داشته باشد. زمانی که از ARMS در تشخیص جهش های نقطه ای استفاده شود، دو نوع پرایمر مکمل با آلل جهش یافته و نرمال طراحی می گردد که پس از انجام PCR با کمک الکتروفورز و مشاهده باندها می توان وجود یا عدم وجود جهش را آنالیز نمود.
دقت آزمایش های ژنتیکی تشخیص جهش های FVL و PGM بیش از 99% است. مزیت روش های مولکولی مبتنی بر DNA این است که توانایی تشخیص جهش بدون وابستگی به فنوتایپ را دارند و برخلاف آزمایش های فنوتایپی و مبتنی بر عملکرد دارای نتایج صریح و روشن هستند. جهش های AT، PC و PS منجر به کاهش میزان یا عملکرد پروتئین های مهار کننده انعقاد می شوند. این جهش ها الگوی وراثتی اتوزومی غالب دارند و حاصل تغییرات ژنتیکی متعدد شامل missense، nonsense، splice-site، مضاعف شدگی، حذف و اضافه هستند. معمولا برای تشخیص این نوع از جهش ها اندازه گیری مقدار پروتئین و یا سنجش عملکرد پروتئین با استفاده از روش های Immunoassay و Chromogenic assay انجام می شود.
درمان ترومبوفیلی
تا امروز درمان مشخصی برای بیماری ترومبوفیلی گزارش نشده است تا زمانی که لخته خون در فرد شکل گیرد. عوارض مرتبط شکل گیری لخته به اندازه و موقعیت شکل گیری آن بستگی دارد. در زنانی که داروهای جلوگیری از بارداری مصرف می کنند، در صورتی که مبتلا به بیماری ترومبوفیلی باشند پزشک اغلب داروهایی را تجویز می کند که فاقد استروژن بوده و فقط پروژسترون دارند.
افرادی که مبتلا به سندرم آنتی فسفولیپید هستند معمولا پزشک معالج داروهای ضد انعقاد خون مانند وارفارین تجویز کرده و توصیه هایی جهت جلوگیری از بروز این عارضه به بیمار ارائه می دهد. به طور کلی، بهترین روش جهت جلوگیری از تشکیل لخته های خونی در افرادی که مستعد این عارضه هستند، تغییر سبک زندگی می باشد. از جمله روش هایی که در جلوگیری از تشکیل لخته موثرند می توان به داشتن تحرک مناسب در طول روز، تناسب اندام و جلوگیری از بالا رفتن وزن، ورزش کردن و کنترل چربی و نمک خوراکی در طول روز اشاره کرد.
منابع علمی
https://www.sciencedirect.com/science/article/pii/S1098360021040430
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7233636/pdf/ACTA-90-44.pdf
https://www.ncbi.nlm.nih.gov/books/NBK544344
https://link.springer.com/article/10.1007/s11239-015-1316-1
https://www.cd-genomics.com/diseasepanel/arms-pcr-in-disease-research.html
https://sci-hub.st/10.1080/17474086.2019.1583555
https://dergipark.org.tr/en/download/article-file/62015
https://thrombosisjournal.biomedcentral.com/articles/10.1186/1477-9560-4-15

