سایتو مگالو ویروس (Cytomegalovirus)
سایتو مگالو ویروس (Cytomegalovirus) یا به اختصار CMV عضوی از خانواده هرپس ویروس ها و یکی از بزرگ ترین ویروس های بیماری زای شناخته شده است. این ویروس که به زیرخانواده بتاهرپس ویروس ها تعلق دارد، عامل گستره ای از سندروم های بالینی از عفونت های بدون علامت در افراد سالم تا بیماری های شدید و کشنده در افراد دچار نقص ایمنی و یا با سیستم ایمنی سرکوب شده می باشد.
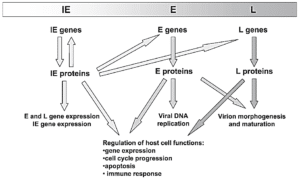
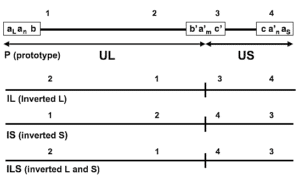
CMV دارای ساختار ایکوزاهدرال (Icosahedral) یا چند وجهی منظم با 20 وجه مثلث متساوی الاضلاع است که قطر آن 150-200 nm می باشد. ساختار ویروس واجد چهار عنصر ساختاری است که عبارتند از پوشش لیپیدی خارجی، Tegument، نوکلئوکپسید و یک مرکز نوکلئوپروتئینی که حاوی ژنوم ویروس است. پوشش ویروسی حاوی لیپوپروتئین ها و پروتئین های ساختاری است که در نفوذ ویروس به درون سلول ها نقش دارند. Tegument نیز حاوی پروتئین های ساختاری از جمله PP65 است؛ این پروتئین مهم ترین هدف تشخیصی در آزمایش های تشخیص ویروس است. ژنوم CMV یک DNA دو رشته ای خطی به طول 64 nm و 235 kb است که حاوی ژن های کد کننده برای 230 پروتئین است. یکی از این پروتئین ها DNA پلیمراز است که در همانند سازی ویروسی نقش دارد و مهم ترین هدف در دارو های ضد ویروسی رایج است. ژنوم CMV انسانی نسبت به تمام هرپس ویروس ها بزرگ تر است و میزان GC بالایی دارد. ژنوم ویروس شامل نواحی unique long (UL)، unique short (US) و repeat regions است. از آنجایی که هر یک از مناطق UL و US می توانند در دو جهت جهت گیری کنند، چهار ایزومر ساختاری برای ژنوم ویروس وجود خواهد داشت. ژنوم ویروس حاوی 7 ناحیه ژنی (A-G) است که پروتئین های لازم برای عملکرد ویروسی، همانند سازی DNA، متابولیسم نوکلئوتید و ساختار ویروس را کد می کنند. در طول دوره بیماری زایی و تکثیر ویروسی، ژنوم ویروسی در یک آبشار منظم بیان و تنظیم می شود که منجر به تولید سه نوع پروتئین شامل immediate-early (IE or α)، early (E or β) و late (L or γ) می شود. ژن های IE مانند UL122/123 در فعال شدن بیان ژنوم ویروسی نقش دارند. علاوه بر این، این ژن ها در فیزیولوژی سلول میزبان از طریق تنظیم بیان ژن های سلولی اثر عمیقی دارند. بیان ژن های E وابسته به حضور پروتئین های IE است. ژن های E بیشتر پروتئین های غیر ساختاری، مانند فاکتور های همانند سازی DNA ویروسی، آنزیم های repair و پروتئین های درگیر در سیستم فرار از ایمنی را بیان می کنند. ژن های L، پروتئین هایی را کد می کنند که بیشتر نقش ساختاری دارند و در تشکیل ساختار و مورفوژنز ویروس شرکت می کنند.
|
|
میزان شیوع عفونت با CMV با افزایش سن افزایش می یابد؛ در کشور های درحال توسعه، میزان شیوع در کودکان 1 تا 5 سال 20.7% بوده و در بالغین با سن بالاتر به 100% می رسد. میزان شیوع سرمی CMV یا seroprevalence وابسته به عوامل مختلفی است؛ این عوامل عبارتند از موقعیت جغرافیایی (میزان شیوع بالاتر در کشور های در حال توسعه)، سن (افزایش میزان شیوع با افزایش سن)، شرایط اجتماعی-اقتصادی (میزان شیوع بالاتر در جوامع پر جمعیت و دچار مشکلات اقتصادی). آلوده شدن با CMV بیشتر در سال های اولیه زندگی، با قرار گرفتن در معرض بزاق، اشک، ادرار، مدفوع، شیر مادر، مایع منی و سایر موارد بدن ترشحات افراد آلوده ویروس بوده اتفاق می افتد. این ویروس تا 6 ساعت روی سطوح زنده می ماند و انتقال از طریق اشیاء آلوده به ویروس نیز ممکن است. همچنین ممکن است انتقال ویروس از طریق پیوند بافت و عضو و یا انتقال خون اتفاق بیفتد.
تظاهرات بالینی عفونت با CMV به سطح ایمنی میزان بستگی دارد. در افراد سالم با ایمنی کامل، عفونت اولیه با CMV معمولا علائمی ندارد. بعد از عفونت اولیه، پس از یک دوره خود محدود شونده، CMV به گستره وسیعی از سلول های بدن وارد می شود. این سلول ها شامل سلولهای اندوتلیال، اپیتلیال، ماهیچه صاف و فیبروبلاست ها و هر قسمتی که ویروس بتواند توسط منوسیت های محیطی و اندوتلیال های در چرخش برسد است. عفونت اولیه منجر به تولید آنتی بادی های اختصاصی CMV (IgM و IgG) در بدن می شود. در افراد سالم دارای سیستم ایمنی کامل تحریک حافظه ایمنی منجر به کنترل تکثیر ویروس در بدن می شود. اما از سوی دیگر از دست دادن سلولهای لنفوسیت T مخصوص CMV (CD4 و CD8) در افرادی که به دلایلی سیستم ایمنی شان سرکوب می شود، می تواند منجر به تکثیر کنترل نشده ویروس و علائم بالینی متعاقب شود. افراد مبتلا به بیماری نقص ایمنی انسان یا AIDS، افراد دریافت کننده پیوند عضو و افراد دریافت کننده سلول های بنیادی هماتوپویتیک که سیستم ایمنی شان نقص دارد یا به واسطه دارو هایی که مصرف می کنند سرکوب میشود، بیشتر در معرض علایم بالینی و بیماری های مرتبط با ویروس CMV هستند.
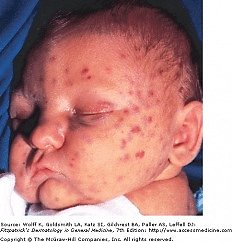
عفونت اولیه با CMV در دوران بارداری می تواند منجر به عفونت داخل رحمی جنین و بیماری عفونت مادر زادی CMV شود. عفونت مادر زادی با CMV معمولا در نوزادانی به وجود می آید که مادرانشان هنگام بارداری دچار عفونت اولیه با CMV میشوند و حدودا در 40% موارد این عفونت به جنین منتقل می شود. ریسک انتقال در صورتی که عفونت در نیمه اول بارداری رخ دهد، بیشتر است. علایم بالینی عفونت مادر زادی با CMV خفیف است و شامل بثورات جلدی، یرقان، هپاتواسپلنومگالی، ناهنجاری های عصبی مانند میکروسفالی و بی حالی، کوریورتینیت و آتروفی عصب بینایی، نارس بودن و وزن کم هنگام تولد می باشد. در 10-15% موارد، عفونت مادر زادی در نوزادان می تواند منجر به کم شنوایی شود.
|
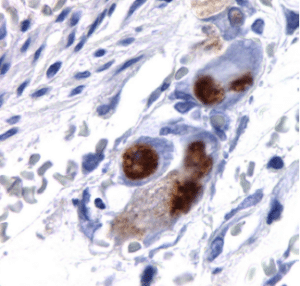
روش های متنوعی برای تشخیص آزمایشگاهی CMV وجود دارد؛ این روش ها به طور کلی به دو دسته تکنیک های مولکولی و تکنیک های غیرمولکولی طبقه بندی می شوند. روش های غیر مولکولی عبارتند از جدا سازی و رشد دادن ویروس از نمونه های خون، ادرار و یا سایر مایعات بدن (کشت ویروس)، اثبات حضور آنتی بادی های IgM و IgG مخصوص ویروس CMV (روش سرولوژی)، تشخیص اجزای ویروسی مانند پروتئین PP65 در لوکوسیت ها (آنتی ژنمیا)، نمایش سلول های nuclear inclusion-bearing (هیستوپاتولوژی). تکثیر نوکلئیک اسید ویروسی یا به اختصار روش های NAT که عمدتا بر پایه PCR هستند بخش بزرگی از روش های مولکولی تشخیص CMV را تشکیل می دهند.
|

|
|
در روش کشت ویروسی نمونه خون، ادرار، ترشحات تنفسی و دیگر نمونه ها به کشت سلولی فیبروبلاست های ریه رویانی تلقیح می شوند و بعد از انکوباسیون سلول ها از نظر وجود سلول های گرد و درشت که نشانه اثر سایتوپاتیک یا وجود CMV است بررسی می شوند. محدودیت کشت ویروسی حساسیت کم آن است، به گونه ای که در مطالعه ای با بررسی نمونه های بیوپسی کبد، حساسیت این روش 52% گزارش شده است. رشد کند CMV در کشت فیبروبلاست های انسانی نیز از دیگر محدودیت های این روش است. از طرفی تکنیک های کشت سلول و ویروس برای مشاهده اثر سایتوپاتیک 1 الی 4 هفته زمان احتیاج دارند. روش سرولوژی و تشخیص آنتی بادی های IgM و IgG مخصوص ویروس CMV نیز در تشخیص عفونت حاد یا عفونت قبلی با CMV کاربرد دارد؛ در این روش از ذرات پوشانده شده با آنتی ژن های CMV استفاده می شود که آنتی بادیهای IgM و IgG مخصوص CMV موجود در پلاسما یا سرم فرد بیمار را شناسایی می کند. آنتی بادی های متصل شده با استفاده از آنزیم horseradish peroxidase شناسایی می شوند. روش سرولوژی نیز محدودیت هایی دارد؛ اول اینکه از زمان بروز علایم بالینی تا افزایش میزان IgM فاصله زمانی وجود دارد که می تواند منجر به تاخیر در تشخیص و درمان می شود. دوم اینکه در بعضی از افراد IgM به مدت طولانی تری بعد از عفونت حاد پایدار می ماند و تشخیص IgM به معنی عفونت فعال نیست. سوم اینکه در افرادی که سیستم ایمنی شان سرکوب شده است پاسخ ایمنی با تاخیر و به صورت ضعیف بروز می کند که منجر به نتایج منفی کاذب در آزمایش سرولوژی می شود. روش آنتی ژنمیا یا تشخیص مستقیم آنتی ژن های CMV مانند پروتئین PP65 در سلول های نوتروفیل با استفاده از آنتی بادی های منوکلونال، یک روش تشخیصی در افراد با نقص ایمنی یا ایمنی سرکوب شده است. حضور PP65 با استفاده از روش های ایمونوفلورسنس، ایمونوپراکسیداز و سایر روش های تشخیص آنتی ژن مشخص می شود. یکی از محدودیت های این روش نیاز به مقدار کافی نوتروفیل است که در بعضی از افراد مثل بیماران لوکوفنیک میسر نمی باشد. از طرفی با این روش فقط سلول های آلوده به ویروس شناسایی می شوند و ویروس های آزاد در مایعات بیولوژیک بدن مثل پلاسما تشخیص داده نمی شوند. محدودیت دیگر این روش این است که باید نمونه ها در مدت زمان کوتاهی (6-8 ساعت) بعد از جمع آوری مورد آزمایش قرار بگیرند. بنابراین این روش نمی تواند برای آزمایشگاه هایی که با حجم زیادی نمونه کار می کنند مفید باشد.
روش های مبتنی بر تکثیر نوکلئیک اسید یا به اختصار NAT برای تشخیص سریع CMV در افراد با نقص ایمنی یا سیستم ایمنی سرکوب شده کاربرد دارند. در واقع این روش ها بر تشخیص یا تکثیر نوکلئیک اسید CMV در نمونه های بالینی متکی هستند. البته از آنجایی که CMV می تواند به صورت نهفته در بسیاری از سلول های دارای هسته وجود داشته باشد، این خطر وجود دارد که روش های مولکولی ویروس غیر فعال را تشخیص دهد. البته روش مولکولی بسیار حساس تر از روش های غیر مولکولی است. در میان روش های مولکولی، روش های مبتنی بر PCR به طور گسترده در تشخیص CMV کاربرد دارند. روش مولکولی امکان تشخیص ویروس در مراحل اولیه عفونت و در زمانی که بار ویروسی کم است و هنوز سطح آنتی بادی بالا نرفته است را فراهم کرده است. در بیشتر روش های مولکولی تشخیص CMV، مولکول هدف، DNA است اما در بعضی موارد تشخیص RNA با استفاده از روش reverse transcriptase-PCR گزارش شده است. تشخیص DNA از حساسیت بالاتری برخوردار است و از آنجایی که مولکول DNA در نمونه پایدار است تاخیر در انجام آزمایش تاثیری در غلظت DNA و تشخیص عفونت با CMV نمی گذارد. با استفاده از روش reverse transcriptase-PCR می توان نگرانی حاصل از ریسک تشخیص CMV های غیر فعال یا نهفته را کاهش داد؛ زیرا مولکول های RNA ویروسی فقط در زمان همانندسازی و تکثیر ویروس وجود خواهند داشت. با این حال تشخیص RNA نسبت به تشخیص DNA حساسیت کمتری دارد و مولکول های RNA نسبت به DNA ناپایدارتر هستند. چندین اهداف ژنی روی CMV DNA برای تکثیر با استفاده از روش PCR به کار رفته است که از میان آن ها می توان به DNA-polymerase gene و glycoprotein B gene اشاره کرد.
روش های مولکولی می تواند به دو صورت کیفی (گزارش منفی یا مثبت بودن تست) و کمی (گزارش مقدار DNA ویروسی) انجام شود. روش های کیفی حساسیت بالایی دارند اما اختصاصیت آن ها نسبت به روش های کمی نسبتا پایین تر است. به علاوه روش های کیفی نمی توانند ویروس فعال و غیرفعال را از هم تشخیص دهند. از طرفی با استفاده از روش های کیفی امکان بررسی در لحظه یا Real-Time پاسخ های درمان های ضد ویروسی وجود ندارد. برای بهبود اختصاصیت و کارایی روش های مولکولی در تشخیص های بالینی روش های مولکولی کمی یا QNAT توسعه یافتند که می توانند میزان ویروس در نمونه را گزارش کنند. از میان این روش ها می توان به روش Real-Time PCR مبتنی بر پروب های TaqMan اشاره کرد که از دقت و حساسیت بالایی در تشخیص CMV برخوردار است.
تکنیک Real-Time PCR کمی یا qPCR روشی است که از PCR برای تکثیر اهداف ژنی مورد نظر، و از مولکول های فلورسنت برای آشکار سازی محصولات تکثیر شده استفاده می کند. بنا بر این در طول واکنش با تکثیر اسید نوکلئیک میزان تابش فلورسنس افزایش می یابد؛ در نتیجه امکان بررسی کمی محصولات PCR به صورت در لحظه یا Real-Time فراهم می شود. دو روش رایج تشخیص ژنوم ویروسی در Real-Time PCR استفاده از رنگ های فلورسنت غیر اختصاصی (مانند سایبرگرین) و یا استفاده از پروب های اختصاصی برچسب گذاری شده با رنگ های فلورسنت (مانند پروب های TaqMan) است. به عنوان یک ابزار تشخیصی، probe-based real-time PCR در تشخیص سریع و دقیق نوکلئیک اسید ویروس های عفونت زا مورد استفاده قرار می گیرد. سه روش متداول Real-Time PCR مبتنی بر پروب که در آزمایش های تشخیصی کاربرد دارد، استفاده از پروب های هیدرولیز شونده یا TaqMan probe، molecular beacon و پروب های هیبرید شونده است. از این روش ها به طور گسترده در تشخیص پاتوژن ها و ویروس های عفونت زا استفاده می شود. برای تشخیص عفونت با CMV نیز کیت های تشخیصی تجاری متعددی بر پایه روش Real-Time PCR کمی طراحی و تولید شده اند که ژن هایی از ژنوم ویروس مانند DNA-polymerase gene و glycoprotein B gene را هدف قرار داده و تکثیر می نمایند.

