بیماری SMA چیست؟
بیماری SMA) Spinal muscular atrophy) نوعی بیماری وراثتی است که ناشی از انحطاط پیش رونده و برگشت ناپذیر نورون های حرکتی در سلول های شاخ قدامی نخاع و هسته های ساقه ی مغز می باشد. این بیماری از لحاظ بالینی (Clinically heterogenous) با طیفی از نشانه ها است که زمان بروز علائم می تواند از پیش از تولد تا بزرگسالی در افراد مختلف با توجه به نوع بیماری اس ام ای متفاوت باشد. مشخصه اصلی این بیماری ضعف و تحلیل رفتن پیشرونده اندام ها است. علائم بالینی شامل فاسیکلاسیون (Fasciculation)، رفلکس های تغییر یافته، اسکولیوز، انقباضات مفصلی و مشکل در تنفس و تغذیه می باشد. با وجود اینکه بیماری SMA نادر می باشد اما یکی از شایع ترین علل ژنتیکی مرگ و میر در نوزادان است.
در بیماری SMA ژن های مختلفی نقش دارند که جهش در ژن SMN1 (Survival Motor Neuron 1) بسیار مهم تر از بقیه می باشد. با وجود اینکه این بیماری جز بیماری های نادر ژنتیکی می باشد اما آمارها نشان می دهند که تعداد افراد مبتلا به بیماری SMA در کشور در حال افزایش است. هزینه های درمان این بیماری بسیار بالا بوده و داروهای مورد نیاز کمیاب هستند، در نتیجه سالانه تعداد زیادی از کودکان در اثر ابتلا به این بیماری ژنتیکی جان خود را از دست می دهند.
انواع بیماری SMA و علائم آنها
بیماری SMA انواع مختلفی دارد که در اثر بروز جهش در ژن های مشابه ایجاد شده و علائم بیماری در سنین مختلفی بروز می یابد. بیماری SMA براساس سن شروع و شدت (severity) بروز علائم در 5 گروه طبقه بندی می گردد که عبارتند از:
-
SMA 0
این نوع از بیماری اس ام ای شدیدترین و نادرترین حالت بیماری است که در نوزادان تازه متولد شده مشاهده می گردد. البته باید توجه داشت که این نوزادان مبتلا اغلب به دلیل مشکلات حاد تنفسی در ماه های اول پس از تولد می میرند، بنابراین ممکن است که علت اصلی بیماری آنها تشخیص داده نشود.
علائم:
- هیپوتونی شدید نوزادی
- آرفلکسی
- نقایص سپتوم دهلیزی
- نارسایی تنفسی در زمان تولد نوزاد
- ضعف شدید
- کاهش میزان حرکات در دوران جنینی
- آرتروگریپوز (Arthrogryposis)
- دو پلژی (facial dipelgia) یا فلج دو طرفه صورت
- از دست رفتن قدرت عضلات تنفسی
- بالا تنه زنگوله ای شکل
- مشاهده گریه های ضعیف در شیرخواران، سرفه های ضعیف و تجمع ترشحات در ریه یا گلو
-
SMA I
بیماری SMA نوع 1 یا بیماری Werdnig-Hoffmann، از شایع ترین انواع این بیماری ژنتیکی است که حدود 80% از افراد مبتلا به این بیماری را شامل می شود. علائم مختلف بیماری در چند ماه اول پس از تولد بروز می یابد که منجر به مرگ آنها در اوایل کودکی می گردد.
علت:
- حذف هموزیگوس اگزون 7 یا 8 و یا اگزون 7 ژن SMN در 96% موارد از SMA I
- حذف هموزیگوس ژن NAIP (neuronal apoptosis inhibitory protein) در 46% موارد
- وجود 1 کپی از ژن SMN2 (Survival Motor Neuron2) در 96% موارد
علائم:
- مشکل در بلعیدن و مکیدن
- انقباضات مفصلی خفیف
- از دست دادن کنترل سر
- ضعف شدید عضلانی
- تونوس ضعیف عضلات
- از دست رفتن قدرت عضلات تنفسی
- مشاهده گریه های ضعیف در شیرخواران، سرفه های ضعیف و تجمع ترشحات در ریه یا گلو
-
SMA II
بیماری اس ام ای نوع 2 یا بیماری Debowitz اغلب در سنین 6 تا 12 ماهگی پس از تولد بروز می یابد که این کودکان مبتلا برای انجام اموری نظیر نشستن، ایستادن و راه رفتن نیاز به کمک دارند. این نوع از بیماری SMA از لحاظ شدت علائم متوسط بوده و طول عمر افراد مبتلا متفاوت است. حدود 70% از بیماران تا سن 25 سالگی می توانند زندگی کنند.
علت:
- حذف هموزیگوس اگزون 7 یا 8 و یا اگزون 7 ژن SMN در 94% موارد
- حذف هموزیگوس ژن NAIP در 17% موارد
- وجود 3 کپی از ژن SMN در 54% موارد
علائم:
- ضعف عضلات پروکسیمال
- تاخیر در رشد و از دست رفتن مهارت ها در حرکت
- لرزیدن انگشتان
- عدم رفلکس های عمیق در تاندون ها
-
SMA III
در بیماری اس ام ای نوع 3 یا بیماری Kugelberg-Welander، علائم بیماری اغلب در سنین بالاتر ار 18 ماهگی بروز می یابند. این نوع از بیماری SMA تأثیری بر طول زندگی مبتلایان نداشته و در برخی موارد مشاهده شده است که تا سنین بزرگسالی علائمی در فرد مشاهده نمی گردد.
علت:
- حذف هموزیگوس اگزون 7 یا 8 و یا اگزون 7 ژن SMN در %82 موارد
- حذف هموزیگوس ژن NAIP در 7% موارد
- وجود 4 کپی یا تعداد بیشتر از ژن SMN2 در 88% موارد
علائم:
- از دست دادن مهارت های حرکتی
- مشکل در دویدن، راه رفتن و یا بالا رفتن از پله ها به دلیل ضعف عضلانی پروکسیمال
- لرزش انگشتان
- احساس خستگی
- غفونت های مکرر در سیستم تنفسی
-
SMA IV
این نوع از بیماری SMA اغلب بر بزرگسالان تاثیر می گذارد و علائم آن ملایم است، بنابراین بر طول زندگی فرد تاثیری نخواهد داشت. این حالت کمترین فراوانی را در بین انواع مختلف بیماری SMA داشته و کمتر از 5% مبتلایان در این گروه قرار می گیرند.
علت:
- حذف هموزیگوس اگزون 7 یا 8 و یا اگزون 7 ژن SMN در 3/0 % موارد
- حذف هموزیگوس ژن NAIP در کمتر از 2% موارد
- وجود 4 کپی یا تعداد بیشتر از ژن SMN2 در 88% موارد
علائم:
- احساس خستگی
- ضعف در عضلات دلتوئید، سه سر و چهار سر ران
- کاهش رفلکس تاندون ها در اندام های فوقانی و آشیل
- لرزش درست ها
نرخ شیوع بیماری SMA
نرخ شیوع این بیماری در جهان حدود 1 نفر در هر 6000 تا 10000 نفر می باشد. بر اساس آمار ارائه شده در منابع معتبر، تعداد مبتلایان بیماری SMA در آمریکا حدود 10000 تا 25000 نفر است و تخمین زده می شود که 1 نفر از هر 54 نفر در ایالات متحده ناقل جهش یا حذف ژنتیکی SMN1 هستند که با فراوانی بیماری در حدود 1 در 11000 تولد زنده مطابقت دارد. در جدول زیر میزان فراوانی ناقلین و افراد مبتلا در جمعیت های مختلف ذکر شده است.
| فراوانی تخمینی بیماران | فراوانی ناقلین |
جمعیت |
| گزارش نشده است | 1:59 | عرب ها |
| 1:8009 | 1:48 | آسیایی ها |
| 1:9655 | 1:71 | سرخپوستان |
| 1:18808 | 1:100 | سیاه پوستان |
| 1:7829 | 1:45 | سفید پوستان |
| 1:20134 | 1:77 | اسپانیایی ها |
| 1:10000 | 1:56 | اسرائیلی ها |
نام های دیگر این بیماری
- 5q SMA
- Proximal SMA
- SMA
- SMA-associated SMA
- Spinal amyotrophy
- Spinal muscle degeneration
- Spinal muscle wasting
علت بروز بیماری SMA و الگوی توارث آن
بیماری اس ام ای یکی از بیماری های ژنتیکی است که در 95% موارد به دلیل جهش از دست رفتن هموزیگوس ژن SMA1 (Survival Motor Neuron 1) ایجاد می گردد. 5% باقی مانده این بیماران جهش حذف هموزیگوس را در اگزون 7 ژن SMN1 را نشان می دهند، اغلب آنها هتروزیگوت مرکب هستند (heterozygous compounds) به این صورت که دارای یک جهش حذف در یکی از آلل ها و یک جهش نقطه ای در آلل دیگر می باشند. الگوی توارث این بیماری اتوزوم مغلوب (Autosomal recessive) می باشد، بنابراین والدینی که ناقل این بیماری هستند با احتمال 25% صاحب فرزند بیمار خواهند شد.
در آن دسته از بیماران SMA که شدت بیماری در آنها بالاست، جهش در ژن دیگری به نام SMN2 نیز مشاهده می شود. ژن SMN2 با تولید محصول پروتئینی همانند ژن SMN1، نقش تعدیل کننده ی (Modifier) شدت بیماری را دارد بنابراین هرچه تعداد نسخه های آن در فرد مبتلا بیشتر باشد، شدت علائم در بیمار کاهش خواهد یافت. در نتیجه اگر در ژنوم فردی، جهش در هر دو ژن مشاهده گردد علائم بیماری بسیار شدیدتر خواهد بود و طول زندگی مبتلایان به بیماری SMA کاهش می یابد. تعداد کپی های ژن SMN2 در انواع مختلف بیماری SMN در جدول زیر به صورت خلاصه آورده شده است.
| SMA III/IV | SMA II | SMA I | تعداد کپی های ژن SMN2 |
| 0% | 4% | 96% | 1 |
| 5% | 16% | 79% | 2 |
| 31% | 54% | 15% | 3 |
| 88% | 11% | 1% | 4=< |
به طور کلی، در بررسی بیماری SMA سه ژن SMN1، SMN2 و NAIP کاندید هستند که در کیت تشخیصی بیماری SMA (Trita® SMA Diagnostic Kit) مورد بررسی قرار گرفته و همگی در ناحیه 5q13.2 واقع شده اند. ژن SMN1 در یک منطقه مضاعف شده در حدود 500 کیلو باز قرار گرفته است که حداقل 5 ژن SERF1، NAIP، SMN1،SMN2 و GTF2H2 در آن ناحیه تکرار شده و هر کدام دارای یک نسخه تلومری و سانترومری هستند. ژن SMN2 در واقع نسخه ی سانترومری ژن SMN1 است و تفاوت این دو ژن تنها در 5 نوکلئوتید واقع شده در ناحیه ʹ3 آنها می باشد. جهش جایگزینی c.840 C>T در اگزون 7 ژن SMN2 باعث پیرایش متناوب (Alternative splicing) در این اگزون و تولید یک رونوشت فاقد اگزون 7 (Δ7-SMN2) می گردد که پروتئین حاصل از این ژن کوتاه شده (Truncated protein) و ناپایدار است و به سرعت تخریب می گردد. از دیگر جهش های شناخته شده می توان به جهش های بدمعنی (missense mutation) c.689 C > T و c.844 C > Tدر ژن SMN1 اشاره کرد.
ژن دیگری که در ناحیه 5q13 واقع شده است، ژن NAIP (5q12.2-q13.3) می باشد که پروتئین مهارکننده آپوپتوز عصبی است که بر تمایز و بقای سلول های عصبی از جمله نورون های حرکتی تأثیر گذار می باشد. نقش عملکرد NAIP در پاتوژنز SMA به طور کامل مشخص نشده است، اما در برخی گزارش ها ارتباط بین جهش حذفی در ژن NAIP (اگزون های 4، 5 و 13) و شدت بروز بیماری SMA نشان داده شده است. این ژن در مجاورت ژن SMN واقع شده و تصور می شود که این ژن اصلاح کننده آتروفی عضلانی نخاعی ناشی از جهش در ژن همسایه، SMN1 است. ژن NAIP کوتاه شده سانترومریک، NAIPψ، فاقد دو اگزون کدکننده 5 و 6 می باشد. نتایج مطالعات مختلف نشان داده است که جهش در ژن NAIP اغلب در افراد مبتلا به بیماری اس ام ای نوع 1 (SMA I) مشاهده می گردد و اگر این ژن به طور کامل دچار حذف شود، وخیم شدن مشکلات تنفسی در بیماران SMA I (نسبت به بیماران SMA I که ژن NAIP در آنها دچار جهش نشده است) بسیار سریع تر خواهد بود. این بیماران اغلب تا قبل از رسیدن به سن 6 ماهگی فوت می کنند اما در صورت زنده ماندن نیاز به مراقبت های تنفس مصنوعی خواهند داشت.
نتایج یک مطالعه بر روی 186 بیمار SMA در ایران که در سال 2023 به چاپ رسیده است نشان می دهد که در همه بیماران مورد بررسی دارای جهش حذف هموزیگوس در اگزون 7 ژن SMN1 بودند. علاوه بر این جهش حذف هموزیگوس اگزون 8 ژن SMN1 نز در حدود 90% افراد مبتلا به این بیماری تشخیص داده شد. از دیگر نتایج ارائه شده در این تحقیقات فراوانی تعداد کپی های (copy number) ژن SMN2 و NAIP E5 در افراد مبتلا به بیماری اس ام ای است که نمودارهای آن در قسمت زیر ارائه شده است.
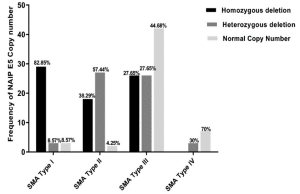
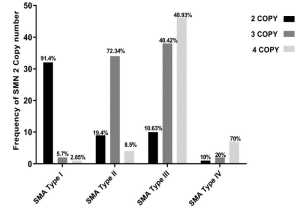
تصویر سمت راست نشان دهنده درصد افراد با تعداد کپی های ژن NAIP و تصویر سمت چپ درصد افراد با تعداد مختلف اگزون 7 ژن SMN2 می باشد.
ژن GTF2H2 (General transcription factor IIH subunit 2) و SERF1 (Small EDRK-Rich Factor 1A) از دیگر ژن هایی هستند که در نزدیکی ژن SMN قرار گرفته اند. ژن GTF2H2 یک زیرواحد 44 کیلو دالتونی از فاکتور شروع رونویسی RNA پلی مراز II را کد می کند. نقش پروتئین تولید شده توسط ژن SERF1 هنوز به طور دقیق مشخص نشده اما حذف نسخه تلومری این ژن اغلب با حذف ژن SMN1 در بیماران SMA همراه است، بنابراین امکان دارد که این ژن نقش اصلاح کننده (Modifier) فنوتیپ در SMA باشد.
روش های تشخیص بیماری SMA
تشخیص بیماری SMA در اولین مرحله از طریق معاینه فیزیکی و بررسی سوابق بیماری فرد مبتلا توسط پزشک معالج می باشد. در صورتی که تشخیص اولیه پزشک بیماری اس ام ای باشد، از طریق برخی آزمایشات می توان به تشخیص دقیق نوع بیماری رسید که برخی از آنها عبارتند از:
-
آزمایش خون
در افراد مبتلا به بیماری SMA سطح آنزیم کراتین کیناز به دلیل تخریب عضلات بالاتر از حد نرمال می باشد.
-
نمونه برداری از عضلات
بیوپسی عضله به معنی برداشتن مقداری از بافت عضلانی و بررسی آن در آزمایشگاه است که برای تشخیص آتروفی و تحلیل بافت ماهیچه مورد استفاده قرار می گیرد.
-
انجام تست عصب و عضله
الکترومیوگرام (EMG) یا تست عصب و عضله از جمله روش های تشخیصی در بیماری اس ام ای است که در آن میزان فعالیت عصبی در عضلات فرد بررسی می گردد.
-
آمنیوسنتز و نمونه برداری از پرزهای کوریونی (CVS)
از روش های تشخیصی CVS و آمنیوسنتز در غربالگری های پیش از تولد و در دوران بارداری استفاده می شود.
-
آزمایش ژنتیک
با توجه به اینکه بیماری SMA بسیار زجرآور بوده و هزینه های درمان بسیار بالایی دارد، می توان در دو سطح مختلف به انجام آزمایش تشخیصی ژنتیک پرداخت. در سطح اول، آزمایش ژنتیک بر روی والدین انجام می شود تا احتمال ناقل بودن آنها مشخص گردد. سطح دوم شامل غربالگری های پیش از تولد است که با کمک تست های ژنتیکی دقیق مانند آزمایش MLPA به بررسی شرایط بالینی جنین پرداخته می شود. در خصوص بیماری ژنتیکی SMA، در صورتی که سابقه این بیماری در خانواده وجود داشته باشد توصیه می شود که در غربالگری های پیش از تولد حتما انجام آزمایش ژنتیک انجام گردد چون احتمال تولد فرزند بیمار از والدین ناقل 25% می باشد.
امروزه آزمایشات ژنتیک مختلفی می توانند در تشخیص بیماری SMA مورد استفاده قرار گیرند که یکی از آنها روش MLPA (Multiplex Ligation-dependent Probe Amplification) است که multiplex PCR می باشد. در روش MLPA از حداکثر 40 پروب متفاوت استفاده می گردد که هر کدام برای شناسایی یک توالی خاص طراحی شده اند. از جمله ویژگی های این روش می توان به توانایی بررسی تعداد کپی ها (copy number variations) در چندین ژن انسانی، تشخیص جهش های حذف یا مضاعف شدن و همچنین شناسایی تغییرات متیلاسیون اشاره کرد. پروب های نشان دار مورد استفاده در این روش به شکل دو نیم پروب 5′ MLPA prob و 3′ MLPA prob سنتز می شوند که مختص شناسایی بک توالی خاص هستند، از سوی دیگر از برخی پرایمر های جهانی (Universal primers) نیز در MLPA استفاده می گردد که امکان تقویت همزمان multiplex PCR را برای همه پروب ها فراهم می کند. این روش دارای محدودیت ها و مزایایی است که در ادامه به آنها پرداخته می شود.
در سال 2013 یک مطالعه در خصوص تشخیص بیماری SMA نوع 1 با کمک تکنیک های MLPA و Real-Time PCR بر روی 1016 نمونه از بیماران انجام شده است. 5 نمونه وجود داشت که در آنالیز هر دو پلتفرم شکست خوردند (0.5%) که نشان می دهد احتمالاً مقادیر DNA استخراج شده از نمونه ها کافی نبوده است. نتایج حاصل از این مطالعه نشان داد که هر دو روش قادر به تعیین دقیق تعداد کپی های اگزون 7 ژن SMN1 هستند.
از سوی دیگر، با وجود اینکه در 99 درصد نمونه ها تعداد کپی های ژن SMN2 به طور دقیق توسط هر دو تکنیک تعیین گردید، اما در 7 مورد مشکلاتی با قابلیت تکرارپذیری سنجش MLPA وجود داشت. در 6 مورد از 7 نمونه، تکنیک MLPA تعداد تکرار ها را بیشتر از تعداد واقعی (3 تکرار به جای 2 تکرار) گزارش کرده بود. این داده ها نشان می دهند که هر دو روش RT-PCR و MLPA برای تعیین تعداد کپی اگزون 7 ژن SMN1 قابل قبول بوده، و برای غربالگری حامل مبتنی بر جمعیت مناسب می باشند.
مزایای روش MLPA:
- استاندارد طلایی برای شناسایی CNV ها درسطح اگزون (در کنار برخی ریزآرایه ها microarrays)
- روشی قدرتمند، سریع و مقرون به صرفه
- وضوح بالا (high resolution)، تشخیص دقیق جهش حذف/مضاعف شدن (deletion/duplication) اگزون
- می توان آن را برای واریانت های تک نوکلئوتیدی خاص (specific single nucleotide variants) (SNVs) طراحی کرد
- امکان تغییر در روش به منظور تشخیص تغییرات متیلاسیون (MS-MPA)
محدودیت های روش MLPA:
- عدم تشخیص بازآرایی های متعادل (balanced rearrangements)
- نبود کیت های تجاری MLPA برای همه ژن ها
- امکان از دست دادن (miss) جهش های کوچک اینترونی در خارج از نواحی مورد بررسی با پروب های کیت
- عدم توانایی در شخیص موقعیت یا جهت ناحیه مضاعف شده
- امکان عدم تشخیص موزائیسم
- عدم تشخیص SNV ها (single Nucleotide Variants) مگر اینکه به طور اختصاصی توالی هدف پروب های MLPA باشد.
- محدودیت تعداد نواحی هدف(target regions) در هر کیت
- در صورتی که ناحیه deletion/duplication به ناحیه خارج از منطقه مورد هدف پروب های کیت گسترش یابد، باید از یک روش دوم دیگری مانند میکرواری نیز استفاده کرد.
- ارائه نتایج مثبت کاذب به دلیل تغییر در توالی محل اتصال پروب یا لیگاسیون (به ویژه برای ژن BRCA1)
- مشاهده نتایج مثبت کاذب در زمان بررسی ژن تشخیص مولکولی دیستروفی عضلانی دوشن/بکر به دلیل تغییر توالی (وجود انواع مختلف توالی ها در افراد یک جمعیت) و در نتیجه اتصال پروب در جایگاه probe hybridization sites
به طور کلی، روش MLPA در پنج مرحله مختلف انجام می شود که عبارتند از:
- دناتوراسیون DNA و انکوبه شدن با پروب های MLPA: در این مرحله با باز شدن دو رشته DNA از یکدیگر، دو نیم پروب ها می توانند توالی هدف را شناسایی می کنند. در صورتی که اتصال پروب به درستی انجام شود و هیچگونه گپی وجود نداشته باشد در مراحل بعد لیگاسیون و تکثیر انجام خواهد شد.
- مرحله لیگاسیون (ligation)
- انجام واکنش PCR و تکثیر قطعه
- تفکیک محصولات PCR با کمک روش کاپیلاری الکتروفورز در شرایط دناتوره کننده
- آنالیز نتایج با بررسی پیک های ارتفاع یا مساحت پیک ها فلورسانس بدست آمده با نرم افزار های مختلی مانند GeneMarker®
کیت تشخیص بیماری SMA تولید شده در شرکت تریتاژن Trita® SMA Diagnostic Kit با استفاده از تکنیک نوین MFPA (Multiple Fluorescent Probe Amplification)، به همراه پرایمر ها و پروب های اختصاصی توانایی تعیین دقیق تعداد کپی ژن های SMN1 و SMN2 در ناحیه اگزون های 7 و 8 و همچنین تشخیص جهش های حذف در اگزون 13 ژن NAIP را دارد که می تواند در تشخیص دقیق این بیماری مورد استفاده قرار گیرد. تکنیک MFPA کاملا مشابه با MLPA می باشد با این تفاوت که مرحله لیگاسیون آن حذف گردیده است.
درمان بیماری SMA
آیا بیماری SMA درمان قطعی دارد؟ با وجود اینکه علت ژنتیکی بیماری SMA مشخص می باشد اما درمان قطعی برای آن در دسترس نیست و تنها با برخی داروها می توان به بازیابی ژن SMN1 یا افزایش میزان بیان ژن SMN2 را به منظور جبران پروتئین FL-SMN دست یافت. در ادامه به معرفی برخی از این داروها خواهیم پرداخت.
Nusinersen (Spinraza) از شراکت Biogen، تخستین دارو جهت درمان مبتلایان بیماری SMA می باشدکه در سال 2016 تائیدیه سازمان غذا و داروی آمریکا (FDA) را دریافت کرده است. این دارو برای بیماران با تمامی ره های سنی قابل استفاده می باشد، از یک الیگونوکلئوتید آنتی سنس 2ʹ-O- متوکسی اتیل (ASO) تشکیل شده است که به منظور افزایش میزان بیان پروتئین SMN طراحی شده است. مکانیسم عملکرد Nusinersen به این صورت است که از طریق اتصال به intron-splicing silencer region N1 در pre-mRNA SMN2 باعث ایجاد اگزون شماره 7 می گردد و در نتیجه توانایی SMN2 در تولید پروتئین FL-SMN توسعه می یابد. البته باید توجه داشته باشید که این دارو نمی تواند از سد خونی مغزی عبور کند بنابراین به صورت داخل نخاعی تجویز می گردد.
AVXS-101 (Zolgensma) یکی دیگر از داروهای مورد استفاده برای بیماران SMA است که در سال 2019 توسط شرکت AveXis تولید شد و تائیدیه FDA را دریافت نمود. داروی AVXS-101، یک AAV9 نوترکیب غیر تکثیر شونده (non-replicating) است که دارای DNA مکمل ژن SMN انسانی است که تحت پروموتر cytomegalovirus enhancer/chicken-β-actin-hybrid قرار دارد. بیماران با تزریق این دارو می توانند بیان سیستمانیک و طولانی مدتی از ژن SMN1 را داشته باشند که این امر باعث بهبود توانایی های حرکتی آنها می شود.
Risdiplam (Evrysdi) تولید شده توسط شرکت Genentech که یکی از اعضای گروه گروه Roche می باشد که در سال 2020 تائیدیه FDA را دریافت نمود. این دارو برای کودکان بالای 2 ماه تا افراد بزگسال به شکل خوراکی قابل استفاده می باشد. Risdiplam یک mRNA splicing modifier است که باعث افزایش بیان پروتئین SMN در فرد مبتلا می گردد.
منابع علمی
https://www.omim.org/entry/253300
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9056474
https://www.ncbi.nlm.nih.gov/books/NBK1352/#sma.Clinical_Characteristics
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7689316
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5242148
https://www.sciencedirect.com/science/article/abs/pii/S1090379816301234
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3317712
https://www.nature.com/articles/s41598-023-30449-7
https://sci-hub.ru/10.1016/j.gene.2012.12.109
https://www.genecards.org/cgi-bin/carddisp.pl?gene=SERF1A#summaries
https://www.genecards.org/cgi-bin/carddisp.pl?gene=GTF2H2&keywords=GTF2H2
https://www.scirp.org/html/5-1370081_33618.htm
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8859565
https://pubmed.ncbi.nlm.nih.gov/22222296
https://pubmed.ncbi.nlm.nih.gov/26743743

