تالاسمی بتا
تالاسمی بتا چیست؟ تالاسمی بتا (Beta-thalassemia) نوعی آنمی وراثتی هتروژن (Heterogeneous) است که به دلیل کاهش یا عدم تولید زنجیره β-globin در افراد بروز می یابد. هموگلوبین در حالت نرمال از دو زنجیره α و دو زنجیره β ساخته شده است که ژن های مرتبط با سنتز زنجیره α روی کروموزوم 16 و ژن های کد کننده زنجیره β روی کروموزوم 11 واقع شده اند. بروز جهش در ژن HBB واقع شده بر کروموزوم 11 منجر به نقص در عملکرد این ژن و بروز انواع مختلف بیماری تالاسمی بتا در افراد می گردد. نقش پروتئین هموگلوبین اتصال به اکسیژن و انتقال آن به بافت ها مختلف بدن است که در افراد مبتلا به تالاسمی بتا به دلیل کمبود یا عدم وجود مقادیر کافی از بتا گلوبین، گلبول های قرمز رشد طبیعی نداشته و فرد علائم مختلفی از جمله کم خونی را بروز می دهد.
سالانه حدود 68000 کودک مبتلا به انواع مختلف بیماری تالاسمی در جهان متولد می شوند و جز بیماری های شایع در دنیا محسوب می شود. الگوی توارث این بیماری به شکل اتوزوم مغلوب است و تقریبا 80 تا 90 میلیون نفر (5/1 % از جمعیت جهان) ناقل تالاسمی بتا در جهان وجود دارد. بالا بودن فراوانی بیماری های مرتبط با هموگلوبین خون در مقایسه با سایر بیماری های تک ژنی، نشان دهنده نقش انتخاب طبیعی و سازگاری افراد ناقل در برابر بیماری مالاریا می باشد. از نظر تاریخی، شیوع بتا تالاسمی در مناقپطق مختلفی از جمله مدیترانه، خاورمیانه، و آسیای جنوب شرقی بسیار بالاست که از دلایل آن می توان رانش ژنی (Gene drift) و اثر بنیانگذار (Funder effects) اشاره کرد.
انواع تالاسمی بتا
با توجه به اینکه بیماری تالاسمی بتا به دلیل کاهش یا فقدان تولید زنجیره β در افراد بروز می یابد، بر اساس شدت بیماری و نوع جهش ها انواع مختلفی دارد که عبارتند از:
1) تالاسمی بتا ماژور (β -thalassemia major)
شدید ترین حالت بیماری تالاسمی بتا، نوع ماژور آن می باشد که با نام کم خونی کولی (Cooley’s anemia) هم شناخته شده است. این حالت زمانی رخ می دهد که هر دو ژن بتا گلوبین دچار جهش شده و پروتئینی تولید نکنند. علائم در افراد مبتلا به این بیماری اغلب در سنین بین 6 ماهگی تا 2 سالگی بروز یافته و نیاز به تزریق مداوم خون می باشد. سطح هموگلوبین ممکن است کمتر از 7 گرم در دسی لیتر و Hb F کمتر از 90 درصد باشد.
کاهش سطح هموگلوبین خون منجر به انبساط مغز استخوان به منظور جبران از دست دادن گلبول های قرمز می گردد که عامل بروز علائمی مانند ناهنجاری های استخوانی، بزرگ شدن طحال و محدودیت رشد خواهد شد. با توجه به اینکه افراد مبتلا به تالاسمی بتا ماژور نیازمند دریافت منظم خون هستند، ممکن است اضافه بار (overload) آهن در اندام های مختلف آنها مشاهده شود که عامل بروز بیماری هایی نظیر دیابت، سیروز کبدی، آریتمی قلبی، رنگ دانه های تیره پوست، کم کاری تیروئید و هیپوفیز و میوپاتی خواهد بود.
علائم:
• تورم شکم
• بروز عفونت های مکرر در فرد
• کاهش سرعت رشد
• بی اشتهایی
• رنگ پریدگی پوست
• رنگ پوست مایل به زرد
• نازک شدن استخوان ها
• ضعف عضلات
• Hepatosplenomegaly (بزرگ شدن کبد و طحال)
• بروز تغییرات اسکلتی و جمجمه ای مانند بدشکلی استخوان های بلند پا و برجستگی پیشانی
• مشاهده زخم در ناحیه پا
• پوکی استخوان
آلل ها:
• βo/βo
• β+/β+
2) تالاسمی بتا اینترمدیا (β-thalassemia intermedia)
این نوع از بیماری تالاسمی بتا یا TI، کم خونی ملایم تری را بروز می دهند بنابراین نیاز به دریافت منظم خون ندارند یا فقط گاهی اوقات نیاز به تزریق خواهند داشت. در بیماران مبتلا به تالاسمی بتا احتمال افزایش بار آهن خون در آنها وجود دارد اما ابتلا به دیابت هیپوگنادیسم (hypogonadism) و کم کاری تیروئید در آنها شایع نیست. در برخی موارد افراد مبتلا به نوع اینترمدیا تا بزرگسالی هیچ نوع علائمی را بروز نمی دهند اما به طور کلی نشانه های این حالت از بتا تالاسمی بسیار نزدیک به تالاسمی ماژور است. سن بروز این بیماری بین 2 تا 6 سالگی می باشد.
علائم:
• زردی
• بزرگ شدن کبد و طحال
• سنگ کلیه
• مشکلات اسکلتی متوسط تا شدید
• سنگ کیسه صفرا
• زخم شدن مکرر پاها
• رنگ پریدگی
آلل ها:
• β+/β+
• β0/β+
3) تالاسمی بتا مینور یا صفت تالاسمی بتا (β-thalassemia minor/trait)
نام دیگر این نوع از تالاسمی بتا، تالاسمی بتا ناقل یا صفت تالاسمی بتا است و زمانی رخ می دهد که تنها یک نسخه از ژن بتا گلوبین دچار جهش شده و نسخه دیگر سالم می باشد. این حالت اغلب بدون علائم بالینی است و در حین استرس های فیزیولوژیک، بارداری و یا در دوران کودکی رخ می دهد. بیتا تالاسمی مینور اغلب نشانه خاصی نداشته و تنها ممکن است که کمی خونی خفیفی مشاهده شود که علت آن ناهنجاری در ظاهر یا مورفولوژی اریتروسیت هاست. سطح هموگلوبین اغلب بیشتر از 10 g/dl می باشد. در صورتی که والدین ناقل تالاسمی بتا باشند، با احتمال 25% فرزند آنها مبتلا به حالت هموزیگوس تالاسمی بتا خواهد شد.
آلل ها:
• β/β+
• β/β0
علت بروز تالاسمی بتا و الگوی توارث آن
ژن کد کننده بتا گلوبین روی بازوی کوتاه کروموزوم 11 واقع شده است که علاوه بر آن ژن های دیگری نظیر ژن δ-globin، ژن ɛ جنینی، ژن های A-γ و G-γ جنینی و یک ژن کاذب (ψB1) نیز در آن ناحیه قرار دارند. اندازه ژن HBB حدود 1.6 kb است که شامل 3 اگزون، 5′-UTR و 3′-UTR می باشد. بیان این ژن تحت تاثیر پروموتری است که در آن TATA Box، CAAT Box و CACCC Box وجود دارد. اصلی ترین توالی تنظیمی که دارای یک enhancer قوی هم می باشد با فاصله 50 kb از ژن HBB واقع شده است که locus control region نامیده می شود.
این ناحیه متشکل از 4 جایگاه حساس یه DNAse خاص اریتروئید (erythroid-specific DNAse hypersensitive sites) یا HS است ( HS-1 تا HS-4) که نشانگر (hallmark) تعامل بین DNA و پروتئین می باشند. هر یک از این جایگاه ها ترکیبی از چندین موتیف DNA است که در تعامل با فاکتورهای رونویسی هستند که برخی از مهم ترین آنها شامل GATA-1 ، اکتور هسته ای اریتروئید 2 (nuclear factor erythroid 2) و KLF1 می باشد. عملکرد این فاکتورهای رونویسی از طریق اتصال و تنظیم بیان ژن هاست به عنوان مثال فاکتور رونویسی KLF1 از طریق اتصال به CACCC Box در تنظیم بیان ژن HBB دخیل است، در صورتی که ژن کد کننده KLF1 در موش غیر فعال یا knockout شود علائم بالینی شبیه به تالاسمی بتا را بروز خواهد داد.
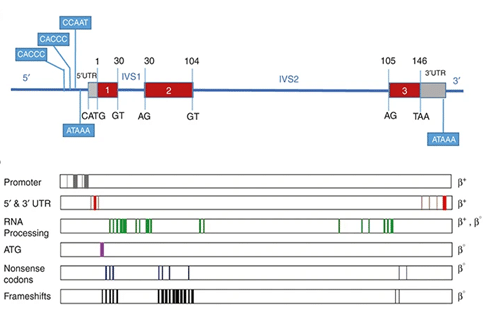
بیماری تالاسمی بتا در سطح ملکولی بسیار هتروژن (heterogeneous) است که الگوی توارث آن اتوزوم مغلوب می باشد. تا کنون بیش از 200 نوع جهش مرتبط با این بیماری گزارش شده که لیست کامل آنها در Globin Gene Server در دسترس می باشد. اکثر ژن های گزارش شده مرتبط با بیماری تالاسمی بتا شامل جایگزینی تک نوکلئوتیدی (single-nucleotide substitutions)، درج تک نوکلئوتیدها (insertions of single nucleotides) و یا تعداد کمی نوکلئوتید است که منجر به جهش های تغییر قالب خوانش (Frameshift mutation) در مناطق کلیدی ژن HBB می گردند.
حالت β0 در بیماری تالاسمی بتا به معنی عدم تولید کامل زنجیره بتا گلوبین است که می تواند به دلایل مختلفی از جمله بروز جهش های حذف، تغییر چارچوب خوانش (frameshift mutation)، nonsense، splice-site junction و … باشد. در مقابل حالت β+ به معنی تولید کم و مقادیر ناکافی از زنجیره β-گلوبین است که در نتیجه وقوع جهش در ناحیه پروموتر (نواحی CACCC Box و یا TATA Box)، سیگنال پلی آدنیلاسیون، ناهنجاری های splicing و جهش در نواحی 3ʹ UTR یا 5ʹ-UTR رخ می دهد. بنابراین با توجه به نوع جهش ها و اثری که بر میزان تولید پروتئین β-گلوبین دارند این بیماری به انواع مختلفی طبقه بندی می گردد.
فنوتیپ یا علائم بالینی در تالاسمی بتا هموزیگوت ممکن است به دلیل وجود یک ناهنجاری ژنتیکی دیگری که خارج از خوشه ژنی HBB قرار دارد، تغییر یابد. یکی از ژن هایی که در تغییر فنوتیپ بیماری تالاسمی بتا موثر بوده و به عنوان Modifying gene شناخته می شود، ژن UGT1A کدکننده Uridine diphosphoglucuronyl transferase می باشد. زمانی که فرد مبتلا به تالاسمی بتا ماژور یا اینترمدیاست و همزمان نقص در ژن UGT1A نیز وجود دارد، منجر به بروز بیماری گیلبرت (Gilbert disease) در فرد می گردد. در جدول زیر تعدادی از جهش های رایج در ژن HBB و شدت بیماری در کشورهایی که شیوع تالاسمی بتا در آنها بالاست ذکر شده است.
لیست جهش ها در ژن β-گلوبین
| Population | Severity | جهش در ژن β |
| مدیترانه | ++β | 101C→T− |
| ژاپن | β0 | −31A→G |
| هند | +β | 619 del- |
| چین | ++β | IVS2‐nt654 C→T |
| آفریقا | ++β | 29A→G− |
| جنوب شرقی آسیا | ++β | 28A→C− |
| آفریقا – آمریکا | ++β | AATAAA to AACAAA |
جهش های مرتبط با تالاسمی بتا
تقریبا اکثر جهش های مرتبط با بیماری تالاسمی بتا از طریق کاهش بیان (down regulation) و به شکل cis-acting عمل می کننئ و در آلل های ژن بتا گلوبین رخ می دهند اما برخی از جهش ها به شکل trans-acting بر بیان این ژن تاثیر می گذارند. تا امروز حدود 300 آلل بتا تالاسمی شناخته شده است که در سایت (http://globin.cse.psu.edu) اطلاعات کامل آنها در دسترس می باشد. برخلاف آلفا تالاسمی که جهش های حذفی در خوشه ژنی ژن α-globin عامل بروز بیماری است، در بیماری تالاسمی بتا اغلب جهش های نقطه ای و جهش در نواحی immediate flanking regions ژن β-globin نقش کلیدی را ایفا می کنند. به طور کلی جهش های مرتبط با تالاسمی بتا به دو گروه انواع حذفی و غیر حذفی طبقه بندی می شوند که عبارتند از:
1) جهش های غیر حذفی
این دسته از جهش ها اصلی نوع تغیرات مشاهده شده در ژن β-globin هستند که شامل جانشینی تک نوکلئوتیدی (single base substitutions)، درج های کوچک (small insertions)، حذف در ناحیه ژنی یا immediate flanking sequences می باشند. این جهش ها می توانند مراحل مختلفی مانند رونویسی، پردازش RNA و ترجمه mRNA ژن بتا گلوبین را تحت تاثیر خود قرار داده و بیان ژن را کاهش دهند، در ادامه به توضیح آنها پرداخته می شود.
• جهش یافته های رونویسی (Transcriptional Mutants)
در این حالت جهش های نقطه ای در توالی DNA حفاظت شده در ناحیه پروموتر ژن β-globin (از حدود 100 نوکلئوتید بالاتر از محل شروع رونویسی که در آن ناحیه توالی های مهمی نظیر CCAAT، CACCC و ATAA قرار دارند) تا حدود 50 نوکلئوتید در ناحیه 5′ UTR رخ می دهند. جهش هایی که در ناحیه CCAAT box رخ می دهند اغلب منجر انواع خفیف تالاسمی بتا می شوند.
برخی از آلل های تالاسمی بتا بسیار علائم ملایمی را در فرد ایجاد می کنند به طوری که در حالت هتروزیگوت (carriers) از لحاظ سطح HbA2 نرمال بوده و گلبول های قرمز تقریبا طبیعی دارند که به این حالت از تالاسمی بتا “Silent” می گویند. این حالت معمولا متداول نمی باشد به جز جهش -101 C →T که در مناطق مدیترانه رایج می باشد. از دیگر جهش های Silent می توان به انواعی اشاره کرد که در ناحیه 5′ UTR رخ می دهند مانند CAP +1 (A→C) (رایج در جمعیت هند) و CAP +8 (C→T) (رایج در جمعیت چین).
• جهش های موثر بر پردازش RNA
طیف وسیعی از جهش ها منجر به بروز تداخل در مرحله پردازش mRNA های اولیه می شوند. این جهش ها در ناحیه دی نوکلئوتیدهای GT یا AG در exon–intron splice junction رخ می دهند که باعث از دست رفتن کامل پیرایش (splicing) شده و فنوتیپ β0-thalassemia ایجاد می گردد. جهش های این ناحیه می توانند از نوع substitutions و یا حذف های کوچک باشند. از انواع این جهش ها می توان به 5 IVS1 G → C, T or A اشاره کرد که باعث کاهش کارایی پیرایش می گردد. جهش IVS1-110 G to A اولین جهش جایگزینی باز (base substitution) شناخته شده در تالاسمی بتاست که در جمعیت مدیترانه بسیار شایع می باشد.
• جهش های عامل Abnormal Posttranscriptional Modification
ملکول mRNA تازه سنتز شده نیاز به مدیفیکاسیون از هر دو انتها 5′ و 3′ دارد تا بتواند عملکردی صحیح داشته باشد. این مدیفیکاسیون شامل اضافه شدن 5′ Capو دم poly-A 3′ است. اضافه شدن توالی دم poly-A از طریق یک توالی هگزانوکلئوتیدی AATAAA در حدود 20 نوکلئوتید بالادست دم poly-A هدایت می شود، در صورتی که جهشی در این ناحیه رخ دهد باعث کاهش کارایی مدیفیکاسیون mRNA و بروز β+-thalassemia خواهد شد.
• جهش های موثر بر ترجمه mRNA ژن β-Globin
جهش هایی که بر کدون آغاز (ATG) تاثیر می گذارند همگی منجر به بروز β0-thalassemia خواهند شد. یکی از جهش های متداول از این گروه درج یک توالی 45 bp بین موقعیت های -22 تا +23 می باشد که بر کدون آغاز تاثیر می گذارد. تقریبا نیمی از آلل های تالاسمی بتا دارای کدون خاتمه زودرس (premature termination codons) هستند که یا جهش ها به طور مستقیم منجر به ایجاد کدون خاتمه شده اند و یا الگوی خوانش (reading frame) را دچار تغییر کرده اند. یکی از جهش هایی که بسیار مورد مطالعه قرار گرفته است در کدون 39 (CAG to TAG) است که دومین جهش شایع تالاسمی بتا در مدیترانه و شایع ترین جهش در ساردیانا می باشد.
2) جهش های حذفی
برخلاف آلفا تالاسمی، بروز جهش های حذفی در تالاسمی بتا نادر می باشد به جز مواردی که حذف یا در خود ژن β-globin رخ داده و یا اینکه جهش ها ناحیه بالادست این ژن را (upstream βLCR) تحت تاثیر خود قرار داده اند.
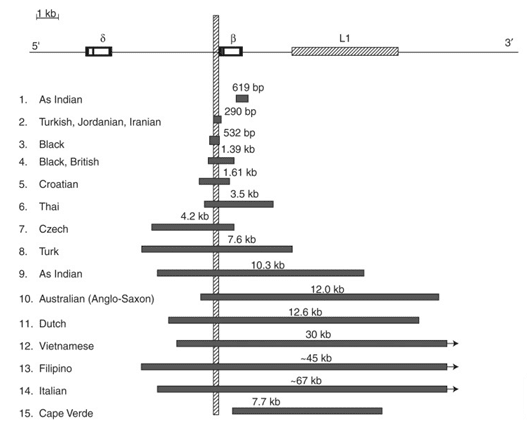
یکی از حذف هایی که بر ژن β-globin اثر گذار است یک حذف به طول 150 bp تا حدود 67 kb است که منجر به بروز β0-thalassemia می گردد.
گروه دیگر از جهش های حذفی در ناحیه بالادست ژن β-globin به نام βLCR رخ می دهند که منجر به کاهش بیان این ژن و تمام ژن های مزتبط با در خوشه ژنی واقع بر کروموزوم 11 می گردد. این نوع جهش منجر به بروز (εγδβ)0-Thalassemia می شود.
نرخ شیوع تالاسمی بتا
تالاسمی بتا از جمله بیماری های شایع در مناطق مختلفی نظیر خاورمیانه، هند، آسیای مرکز ، جنوب چین، آمریکای جنوبی و کشورهای ناحیه ساحلی آفریقا است که بر اساس آمارهای گزارش شده بیشترین نرخ ناقلین در مالدیو (18%)، قبرس (14%)، سادرینیا (3/10%) و آسیای جنوب شرقی می باشد.
از علل بالا بودن فراوانی بالای بیماری تالاسمی بتا و افراد ناقل آن در این مناطق می توان به وجود بیماری مالاریا (پلاسمودیوم فالسیپاروم) و ازدواج های بین خویشاوندان اشاره کرد. سالانه حدود 60000 نفر با علائم این بیماری متولد می شوند و تخمین زده شده است که تقریبا 80 تا 90 میلیون نفر از جمعیت جهان ناقل این تالاسمی بتا هستند. به طور کلی، نرخ شیوع این بیماری 1 مورد در هر 10000 تولد در اروپا و 1 مورد در هر 100000 نفر در جهان می باشد. با توجه به اینکه این بیماری اتوزوم است، تحت تاثیر جنسیت افراد قرار نمی گیرد و هم زنان و هم مردان به این بیماری مبتلا می شوند.
نام های دیگر تالاسمی بتا
• Erythroblastic anemia
• Mediterranean anemia
• Thalassemia, beta type
روش های تشخیص تالاسمی بتا
برای تشخیص بماری تالاسمی بتا چندین روش آزمایشگاهی و ژنتیکی وجود دارد. از تست های متداول آزمایشگاهی که در زمینه تشخیص این بیماری استفاده می شوند می توان به شماره کامل خون (CBC)، اسمیر خون (blood smear)، تست تشخیص پیش از تولد (مایع آمنیوتیک و آزمایش ژنتیک) و تست های ملکولی اشاره کرد.
در تست CBC کم خونی میکروسیتیک (microcytic anemia) مورد بررسی قرار می گیرد. تالاسمی ماژور به وسیله کاهش سطح Hb (<7 g/dl) ، میانگین corpuscolar volume (MCV) > 50 < 70 fl و میانگین corpuscolar Hb (MCH) > 12< 20 pg مشخص می شود. تالاسمی اینترمدیا از طریق سطح هموگلوبین بین 7 تا 10 گرم در دسی لیتر، MCV بین 50-80 fl و MCH بین 16-24 pg و تالاسمی مینور نیز با کاهش MCV و MCH و افزایش سطح Hb A2 تشخیص داده می شوند.
اسمیر خون محیطی در افراد مبتلا به تالاسمی بتا، تغیرات مورفولوژیکی RBC را با میکروسیتوز (microcytosis)، هایپوکرومی، anisocytosis، poikilocytosis و RBC های هسته دار نشان می دهد. در افرادی که ناقل تالاسمی بتا هستند کاهش سطح MCV و MCH و همچنین تغییرات مورفولوژیک RBC مشاهده می شود اما این تغییرات در حد تالاسمی ماژور شدید نمی باشد.
الگو یا Hb pattern در بین انواع مختلف تالاسمی بتا متفاوت می باشد به طوری که HbA2 در افراد مینور افزایش یافته و در بیماران همزیگون و هتروزیگون مرکب متغییر می باشد. در هموزیگوت های β0 زنجیره بتا اصلا ساخته نشده و HbF حدود 90 تا 95 درصد از کل هموگلوبین فرد را تشکیل می دهد. در هموزیگوت های β+ و انواع β+/ β0، HbF حدود 70 تا 90 درصد و HbA حدود 10 تا 30 درصد از کل هموگلوبین خون را بسته به میزان کاهش سطح زنجیره بتا تشکیل می دهد. تکنیک های آنالیز کمی و کیفی هموگلوبین از طریق الکتروفورز استات سلولز و میکروکروماتوگرافی DE-52 و یا HPLC در تعیین مقدار و نوع هموگلوبین های موجود در خون مورد استفاده قرار می کنند.
امروزه روش های ملکولی که در زمینه تشخیص بیماری تالاسمی بتا مورد استفاده قرار می گیرند اغلب بر مبنای PCR و با استفاده از شناسایی جهش های رایج هستند. از متداول ترین این روش ها می توان به ARMS و MFPA اشاره کرد.
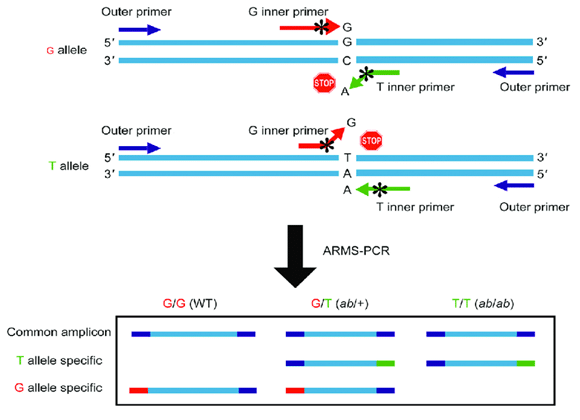
• ARMS
تکنیک ARMS (Amplification-Refractory Mutation System) یک روش ساده جهت شناسایی هرگونه جهش به خصوص جهش های نقطه ای (point mutations) و حذف های کوچک (small deletions) می باشد. این تکنیک به عنوان یک روش استاندارد طلایی (gold standard) به منظور تشخیص بیماری های تالاسمی و کم خونی داسی شکل معرفی شده است. اساس این روش استفاده از پرایمرهای PCR مختص یک توالی خاص با اتصال دقیق انتهای ‘ 3 پرایمر به رشته الگو به منظور تکثیر با PCR است. تکثیر قطعه مدنظر زمانی در این روش انجام خواهد شد که آلل با توالی هدف در ژنوم حضور داشته باشد. زمانی که از ARMS در تشخیص جهش های نقطه ای استفاده شود، دو نوع پرایمر مکمل با آلل جهش یافته و نرمال طراحی می گردد که پس از انجام PCR با کمک الکتروفورز و مشاهده باندها می توان وجود یا عدم وجود جهش را آنالیز نمود.
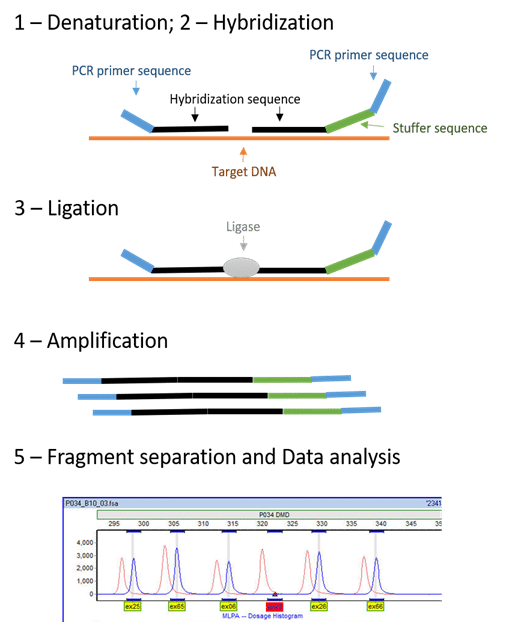
• MLPA
تکنیک MLPA (Multiplex Ligation-dependent Probe Amplification)، روش ساده، آسان و با بازدهی بالاست که در تشخیص ناهنجاری های ژنتیکی مختلف مانند تغییرات DNA copy number، انیوپلوئیدی ها، جهش های deletion/duplication، بازآرایی های ساب تلومریک (sub telomeric rearrangements) و وضعیت متیلاسیون مورد استفاده قرار می گیرد. در این روش از حداکثر 40 پروب مختلف برای توالی های متفاوت استفاده می شود که هر کدام از دو عدد نیم پروب (یکی از نیم پروب ها نشان دار می باشد) که در مجاورت هم به ناحیه مکمل توالی خود متصل می گردند، تشکیل شده است. زمانی پروب ها کاملا با توالی هدف هیبرید می شوند آنزین لیگاز آن دو را به هم متصل می کند و واکنش PCR انجام می گردد. از سوی دیگر از برخی پرایمر های جهانی (Universal primers) نیز در MLPA استفاده می گردد که امکان تقویت همزمان multiplex PCR را برای همه پروب ها فراهم می کند.
تکنیک MLPA در 5 مرحله مختلف انجام می شود که عبارتند از:
1) دناتوراسیون DNA و انکوبه شدن با پروب های MLPA: در این مرحله با باز شدن دو رشته DNA از یکدیگر، دو نیم پروب ها می توانند توالی هدف را شناسایی می کنند. در صورتی که اتصال پروب به درستی انجام شود و هیچگونه گپی وجود نداشته باشد در مراحل بعد لیگاسیون و تکثیر انجام خواهد شد.
2) مرحله لیگاسیون (ligation)
3) انجام واکنش PCR و تکثیر قطعه
4) تفکیک محصولات PCR با کمک روش کاپیلاری الکتروفورز در شرایط دناتوره کننده
5) آنالیز نتایج با بررسی پیک های ارتفاع یا مساحت پیک ها فلورسانس بدست آمده با نرم افزار های مختلفی مانند ®GeneMarker
در کیت تشخیص تالاسمی بتا شرکت تریتاژن از تکنیک نوین MFPA (Multiple Fluorescent Probe Amplification)، به همراه پرایمر ها و پروب های اختصاصی جهت تشخیص این بیماری استفاده می کند. تکنیک MFPA کاملا مشابه با MLPA می باشد با این تفاوت که مرحله لیگاسیون آن حذف گردیده است.
درمان تالاسمی بتا
افرادی که مبتلا به تالاسمی بتا مینور هستند نیاز به درمان ندارند و تنها در زمان فرزندآوری می توانند از طریق مراجعه به مشاور ژنتیک راهکارهای مناسب جهت جلوگیری از انتقال بیماری به نسل بعد را دریافت کنند. از سوی دیگر، افراد مبتلا به تالاسمی اینترمدیا مقداری کم خونی خفیف را در زندگی خود تجربه می کنند که در برخی موارد نیاز به دریافت خون خواهند داشت. در مبتلایان به تالاسمی بتا ماژور و اینترمدیا زمانی که شرایط حاد باشد روش های درمانی مختلفی ممکن است مورد استقاده قرار گیرند که برخی از آنها عبارتند از:
• برداشت طحال (Splenectomy): در بیناران بمتلا به تالاسمی ماژور و اینترمدیا به علت همولیز شدید (severe hemolysis) طحال دارای فعالیت بیش از حد است که منجر به بزرگش شدن طحال (splenomegaly) می گردد. برداشتن طحال زمانی توصیه می گردد که نیاز به تزریق بیش از 200 تا 220 میلی لیتر RBCs/kg با 70 درصد هماتوکریت و همچنین گلبولهای قرمز RBCs 250–275 ml/kg packed با 60 درصد هماتوکریت در سال باشد.
• پیوند مغز استخوان: یکی از روش های درمانی با کارایی بالا در تالاسمی بتا پیوند مغز استخوان می باشد که نیاز به تطابق مارکر HLA فرد دهنده و گیرنده است.
• تزریق خون: در افراد مبتلا به تالاسمی بتا ماژور، تزریق خون به منظور حفظ سطح هموگلوبین پلاسما و درمان آنمی که در نتیجه endogenous erythropoiesis ایجاد میگردد، انجام می شود.
منابع علمی
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8683628
https://www.nature.com/articles/gim2016173
https://www.ncbi.nlm.nih.gov/books/NBK531481
https://www.ncbi.nlm.nih.gov/books/NBK1426/pdf/Bookshelf_NBK1426.pdf
https://sci-hub.st/10.1002/0471142905.hg0908s07

