لوسمی حاد میلوئیدی (AML)
لوسمی حاد میلوئیدی (Acute myeloid Leukemia) یا به اختصار AML، نوعی سرطان خون است که به عنوان یک بیماری هتروژن (Heterogeneous) شناخته می شود. این بیماری به وسیله گسترش کلونال پیش سازهای میلوئیدی یا بلاست ها (clonal expansion of myeloid progenitors) در مغز استخوان و خون محیطی مشخص می گردد. بیشترین اثر گذاری این بیماری بر گلبول های سفید خون (WBC) است. در گذشته بیماری سرطان AML جز بیماری های لاعلاج محسوب می شد اما امروزه حدود 35% تا 40% از بیماران با سنین 60 سال یا کمتر و تقریبا 5 تا 15 درصد از مبتلایان بالای 60 سال درمان می شوند. AML متداول ترین نوع لوکمی در بزرگسالان است و سرعت پیشرفت بیماری بسیار بالا می باشد. نرخ شیوع این بیماری حدود 4 نفر در هر 100000 نفر بزرگسال می باشد و سالانه 1160 کودک مبتلا به این بیماری تشخیص داده می شوند.
نشانه های اولیه سرطان AML بسیار شبیه به آنفولانزا و سایر بیماری های رایج است که این امر می تواند منجر به عدم تشخیص درست و به موقع آن گردد. معمولا علائم بیماری بین 4 تا 6 هفته ایجاد می گردند. از جمله علائم بیماری AML می توان به موارد زیر اشاره نمود که عبارتند از:
• احساس خستگی
• عفونت های مکرر
• تب کردن
• خونریزی های غیر معمول
• رنگ پریدگی پوست
• ضعف
• کاهش وزن
فاکتورهای خطر
برخی فاکتورها و عوامل می توانند خطر بروز سرطان AML را در افراد افزایش دهند که به عنوان فاکتور خطر (risk factor) شناخته می شوند. برخی عوامل که می توانند خطر بروز AML را در افراد افزایش دهند عبارتند از:
• جنسیت (خطر بروز AML در مردان بالاتر از زنان است)
• استعمال دخانیات
• بالارفتن سن
• داشتن سابقه شیمی درمانی یا پرتو درمانی در گذشته
• ابتلا به برخی بیماری های ژنتیکی و سندرم ها مانند آنمی فانکونی، آتاکسی تلانژکتازی، سندرم داون، کلاین فلتر و سندرم بلوم
• داشتن سابقه ابتلا به بیماری های خونی مانند میلودیسپلازی (myelodysplasia)
• کار کردن در محیط های دارای اشعه رادیواکتیو
نام های دیگر این بیماری
سرطان AML با نام های دیگری نیز شناخته می شود که عبارتند از:
• acute myelocytic leukemia
• acute myelogenous leukemia
• acute granulocytic leukemia
• acute non-lymphocytic leukemia
انواع AML
در دهه 1970، گروهی از متخصصین لوکمی فرانسوی-آمریکایی-انگلیسی بیماری AML را براساس نوع سلول های منشع سرطان خون و میزان بلوغ سلول ها به انواع مختلفی به صورت M0 تا M7 طبقه بندی کردند. اساس این طبقه بندی مورفولوژی سلول های لوکمی پس از رنگ آمیزی در زیر میکروسکپ بود. این رده بندی با نام FAB (French-American-British classification) شناخته می شود.
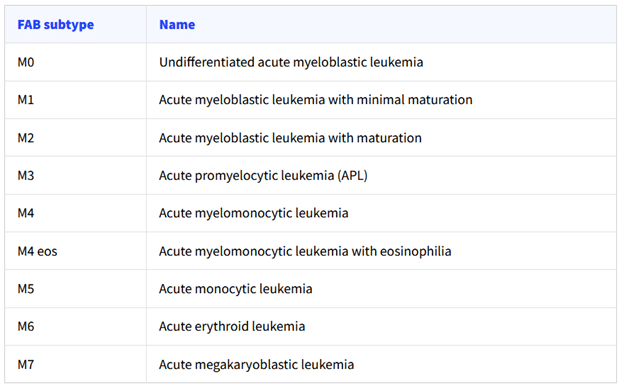
درسال 2016، سازمان بهداشت جهانی (WHO) طبقه بندی جدیدی از بیماری AML را ارائه داد که ادامه به آن پرداخته می شود. در این سیستم بیماری AML به چند گروه تقسیم می گردد که عبارتند از:
1) AML با ناهنجاری های ژنتیکی خاص (تغییرات ژن یا کروموزوم)
• AML با ترانسلوکاسیون بین کروموزوم های 8 و 21 [t(8;21))]
• AML با ترانسلوکاسیون یا وارونگی در کروموزوم 16 [t(16;16) or inv(16)]
• APL با ژن فیوژن PML-RARA
• AML با ترانسلوکاسیون بین کروموزوم های 9 و 11 [t(9;11))]
• AML با ترانسلوکاسیون بین کروموزوم های 6 و 9 [t(6:9))]
• AML با ترانسلوکاسیون یا وارونگی در کروموزوم 3 [(3;3)t or inv(3)]
• AML (مگاکاریوبلاستیک) با جابجایی بین کروموزوم های 1 و 22 [t(1:22))]
• AML با ژن فیوژن BCR-ABL1
• AML با ژن جهش یافته NPM1
• AML با جهش بی آللی ژن CEBPA (یعنی جهش در هر دو نسخه از ژن)
• AML با ژن RUNX1 جهش یافته
2) Myeloid sarcoma
3) مواردی از AML که جز طبقه بندی FAB قرار دارند (AML not otherwise specified)
• AML با حداقل تمایز (FAB M0)
• AML بدون بلوغ (FAB M1)
• AML با بلوغ (FAB M2)
• لوکمی میلومونوسیتی حاد (FAB M4)
• لوکمی حاد مونوبلاستیک/مونوسیتیک (FAB M5)
• لوکمی اریتروئید خالص (FAB M6)
• لوکمی مگاکاریوبلاستیک حاد (FAB M7)
• لوکمی بازوفیلیک حاد
• پانمیلوز حاد همراه با فیبروز
2) AML تغییرات مرتبط با میلودیسپلازی (AML with myelodysplasia-related changes)
3) Myeloid sarcoma
4) AML related to previous chemotherapy or radiation
5) Myeloid proliferations related to Down syndrome
6) Undifferentiated and biphenotypic acute leukemias
علت بروز AML
به طور کلی، بیماری AML به دلیل بروز جهش در ژن های دخیل در مسیر خون سازی (Hematopoiesis) رخ می دهد. این جهش ها عامل گسترش کلونال پیش سازهای میلوئیدی تمایز نیافته (undifferentiated myeloid precursors) یا بلاست در خون محیطی و مغز استخوان شده که در نهایت منجر به اریتروپوئیزیز بی اثر (ineffective erythropoiesis) و نارسایی مغز استخوان خواهد شد. نتایج مطالعات مختلف نشان می دهد که تجمع جهش های مکرر ژنتیکی در سلول های بنیادی خونساز با بالا رفتن سن، می تواند از علل بروز این نوع سرطان خون باشد.
در اغلب موارد ابتلا به AML، جهش ها به صورت نوظهور (de novo) ایجاد شده اند. از سوی دیگر، برخی بیماری ها مانند myeloproliferative disorders (MPD)، سندرم میلودیسپلاستیک (MDS)، هموگلوبینوری شبانه حمله ای و کم خونی آپلاستیک می توانند منجر به بروز این نوع سرطان در فرد شوند. علاوه براین، وجود سابقه خانوادگی در ابتلا به این بیماری می تواند خطر بروز آن را در افراد افزایش دهد. بیماری AML یکی بیماری ژنتیکی ناهمگن است که منجر به بروز بدخیمی های خونی می شود.
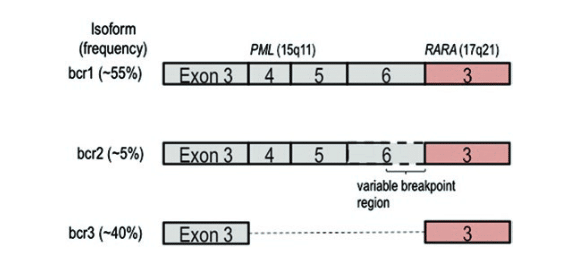
در این امر بازآرایی ها و برخی ترانسلوکاسیون های رایج عبارتند از t(8;21)(q22;q22)، t(15;17)(q22;q21) و inv(16)(p13.1;q22) هستند که به ترتیب منجر به ایجاد رونوشت های فیوژن RUNX1-RUNX1T1، PML-RARA و CBFB-MYH11 می شوند. وجود رونوشت فیوژن PML-RARA هالمارک (hallmark) برای بیماری Acute Promyelocytic Leukemia یا به اختصار APL است. این ناهنجاری های سیوژنتیکی پیش آگاهی مناسبی را ایجاد می کنند. برای رونوشت PML-RARA سه ایزوفورم مختلف با نام های bcr1، bcr2 و bcr3 شناخته شده است که تفاوت آنها در نقطه شکست در PML می باشد.
نقطه شکست PML در bcr1 به شکل اینترونی است که منجر به تولید یک رونوشت فیوژن بین اگزون 6 از PML و اگزون 6 از RARA می گردد. نقطه شکست bcr2 در نواحی مختلفی درون اگزون PML 6 رخ می دهد و با اگزون RARA 6 ترکیب می گردد. نقطه شکست PML در bcr3 نیز اینترونی است و بین اگزون 3 PML و اگزون 6 از RARA رخ می دهد.
به طور کلی، جهش های مرتبط با AML می توانند در سطح سیوژنتیکی و ناهنجاری های ملکولی مورد بررسی قرار گیرند که عبارتند از:
1) سیوژنتیکی
سرطان AML یک بیماری بسیار هتروژن (heterogeneous) است که عوامل مختلفی نظیر جهش های ژنتیکی، ترانسلوکاسیون های کروموزومی و یا تغییرات در سطح ملکولی می توانند در بروز آن دخیل باشند. ناهنجاری های غیر تصادفی کروموزومی (مانند حذف و ترانسلوکاسیون) اصلی ترین علت بروز بیماری AML است و در حدود 52 درصد بیماران مشاهده می شود. برخی ناهنجاری های سیتوژنتیکی مشخص مانند t(8;21)(q22;q22)، t(15;17)(q22;q12) و inv(16)(p13.1;q22) با بقا و بهبود بیماری مرتبط هستند.
از سوی دیگر، بروز تغییرات (مونوزومی) در کروموزوم های 5 و 7، کاریوتایپ های پیچیده و جهش 11q23 در پاسخ دهی ضعیف فرد مبتلا به روند درمان و کوتاه شدن زمان بقا دخیل هستند. حدود 40 تا 50 درصد از افراد مبتلا به AML از لحاظ سیتوژنتیکی نرمال هستند (CN-AML). افرادی که دارای ترانسلوکاسیون t(8;21) هستند اگر جهش c-KIT در آنها رخ دهد، خطر عود مجدد افزایش یافته و تاثیر منفی در مدت زمان بقای فرد خواهد داشت.
2) ناهنجاری های ملکولی
با ظهور روش توالی یابی نسل بعدی (NGS)، 13 جهش مختلف مرتبط با بیماری AML شناسایی شده است که 5 مورد از آنها جز جهش های driver و 8 مورد باقی مانده از نوع passenger هستند. در ادامه شایع ترین جهش های مرتبط با بروز سرطان AML معرفی می گردد که عبارتند از:
• جهش نوکلئوفوسمین 1 (NPM1)
نوکلئوفوسمین (Nucleophosmin) یا به اختصار NPM1، که با نام های دیگری نظیر B23، No38 یا Numatrin نیز شناخته می شود از جمله پروتئین های فراوان هسته ای است که عمدتا در هسته سلول های در حال تکثیر یافت می گردد. از عملکردهای این پروتئین می توان به مواردی از جمله بیوژنز ریبوزوم، ترمیم DNA و تنظیم آپوپتوز اشاره کرد. با وجود اینکه بخش عمده این پروتئین در ناحیه گرانولار هسته یافت می شود ما به صورت مداوم در حال جابه جایی بین هسته و سیتوپلاسم می باشد.
Nucleophosmin 1 mutation یا به اختصار (NPM1)، متداول ترین نوع جهش در بیماری AML است که در حدود حدود 25 تا 30 درصد از مبتلایان مشاهده می شود. این جهش شیوع بالاتری در زنان دارد. جهش تغییر چارچوب (frame shift) در اگزون 12 در ژن NPM1 با موقعیت ژنی 5q35 عامل بیان نابجای پروتئین در سیتوپلاسم (Cytoplasmic NPM1 – NPM1c) به جای هسته است که در نتیجه منجر به تحریک تکثیر میلوئید و پیشرفت لوکمی می گردد. اکثر جهش های ژن NPM1 در ناحیه اگزون 12 رخ داده و تا امروز بیش از 50 جهش مختلف در رابطه با این ژن گزارش شده است. جهش های ژن NPM1 در 3 گروه مختلف طبقه بندی می شوند که عبارتند از:
• گروه A که شامل 75% تا 80% از کل جهش های ژن NPM1 در بیماری AML می باشد. جهش این گروه مضاعف شدگی تترانوکلئوتید TCTG (TCTG tetranucleotide duplication) است.
• گروه B که جهش آن به شکل درج (Insertion) توالی 4 bp (CATG) می باشد. این گروه 10% از کل جهش های رخ داده در ژن NPM1 را در بر می گیرد.
• گروه D که سومین گروه جهش های شایع در ژن NPM1 می باشد که دارای جهش درج توالی 4 bp (CCTG) است.
در تحقیقات مختلف برخی جهش های نادر در ژن NPM1 در نواحی اگزون های 5، 9 و 11 نیز گزارش شده اند که منجر به قرار گیری محصول این ژن در سیتوپلاسم می گردد. از لحاظ بالینی، این جهش با مورفولوژی monocytic همراه است. جهش NPM1 در غیاب FMS-Like tyrosine Kinase 3 یا به اختصار FLT3-ITD منجر به یک prognosis یا پیش آگاهی مطلوب در بیماران می شود که هنوز علت آن مشخص نشده است. از سوی دیگر، مشخص شده است که حدود 40% از بیماران AML که دارای جهش NPM1 هستند، جهش FLT3-ITD را نیز دارند. به طور کلی، جهش های که در NPM1 رخ می دهند منجر به پاسخ دهی بهتر بیماران در دوره شیمی درمانی به داروهای تجویزی خواهد شد.
• جهش DNA متیل ترانسفراز 3A (DNMT3A)
جهش در ژن DNMT3A در حدود 18 تا 22 درصد از افراد مبتلا به AML و حدود 34 درصد از موارد CN-AML وجود دارد. جهش های بدمعنی (missense mutations) که بر آرژنین کدون 882 (R882-DNMT3A) تاثیر می گذارند، نسبت به سایر جهش ها (non R882-DNMT3A) که بر سایر کدون ها موثر هستند. متداول تر است. این جهش منجر به بروز اختلال در روند طبیعی خونسازی (hematopoiesis) و متیلاسیون مناسب می شود. اخیرا جهش های DNMT3A به عنوان جهش های pre-leukemia شناخته می شوند که در مراحل اولیه بیماری AML رخ می دهند. بیماران جوانی که دارای جهش های non R882-DNMT3A طول عمر کوتاه تری نسبت به سایرین دارند.
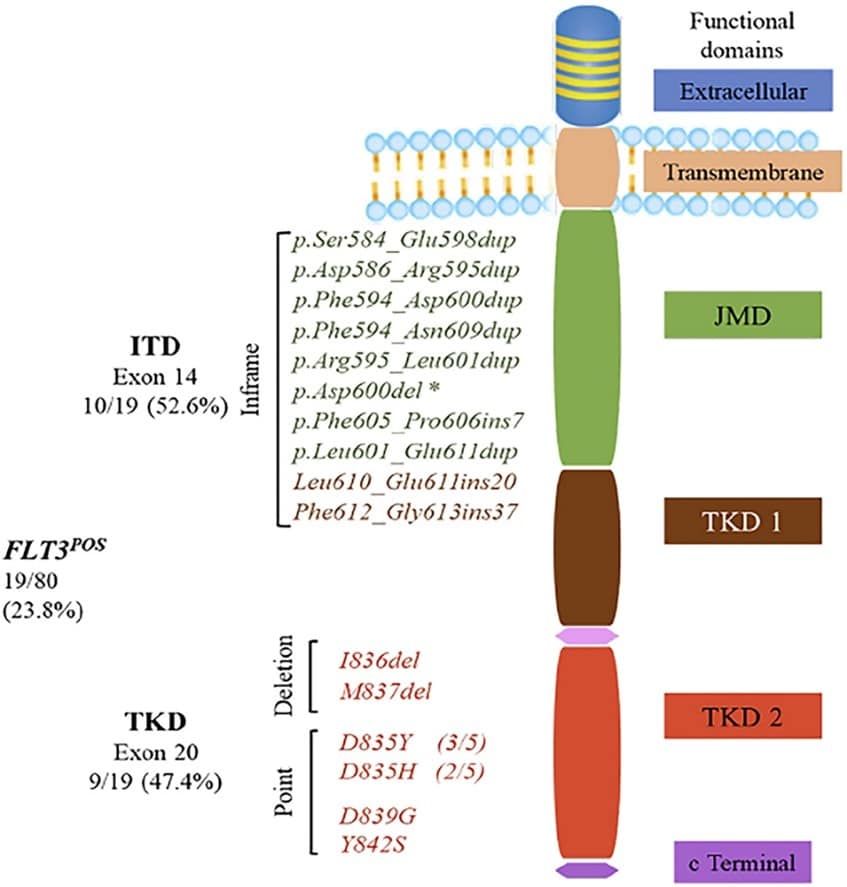
• جهش Fms-Like Tyrosine Kinase 3 (FLT3)
ژن تیروزین کیناز 3 شبه FMS (FLT3) که در موقعیت 13q12 قرار دارد، یک گیرنده تیروزین کیناز (RTK) متصل شونده به غشاء را کد می کند که متعلق به خانواده RTK زیر کلاس III است. همچنین به عنوان کیناز سلول های بنیادی 1 (STK1) یا کیناز کبد جنینی 2 (Flk2) نیز شناخته می شود. این جهش برای نخستین بار در سال 1991 یافت شد که به میزان بالایی در سلول های بنیادی خون ساز بیان می گردد. جهش FLT3 نقش خیلی مهمی در بقای سلول ها و تکثیر آنها ایفا کرده و شایع ترین جهش سوماتیک مرتبط با بیماری AML می باشد.
در بیماران AML، دو نوع جهش فعال کننده (activating mutations) شناسایی شده است:
1) تکرار پشت سر هم داخلی (Internal tandem duplications) یا به اختصار ITD که در ناحیه کدکننده دامنه (Domain juxta-membrane) یا JM، با درج توالیهای اسید آمینه مکرر تعیین می شود. ITD شایع ترین جهش FLT3 است که در بیماران AML یافت می گردد. جهش IDT شامل یک عدد in-frame duplication به طول 3-400 bp در ناحیه کد کننده دومین JM می باشد. این جهش منجر به دایمریزاسیون مستقل از لیگاند و اتوفسفریلاسیون تیروزین رسپتور ها و همچنین فعال شدن مسیر های سیگنالینگ PI3K/AKT، RAS/MAPK و STAT5 خواهد بود. بیماران FLT3-ITD اغلب دارای کایوتایپ نرمال t(15;17)/PML-RARA، t96;9)/DEK-CAN و t915;16) هستند.
2) جهش های نقطه ای که باعث جایگزینی اسید آمینه در حلقه فعال سازی دومین تیروزین کیناز (Tyrosine Kinase Domain) یا TKD می گردند. نرخ شیوع جهش های FLT3-TKD در مقایسه با گروه FLT3-ITD پایین تر است. یکی از مهم ترین جهش های نقطه ای بد معنی (missense point mutation) در ناحیه آمینواسید D835(D835Y و D835H) در دومین domain از TKD یا TKD2 است که امروزه در کیت های مختلف تشخیص بیماری AML مورد بررسی قرار می گیرد. از دیگر جهش های deletion در ناحیه TKD2 می توان به I836 و M837 اشاره کرد.
ITD در Domain juxta-membrane و جهش دوم دومین second tyrosine kinase domain در ژن FLT3 در حدود 20% از افراد مبتلا به بیماری AML و 30% تا 45% از افراد CN-AML یافت می گردد. تاثیر هر دو نوع جهش در فعال سازی مسیر سیگنالینگ FLT3 و افزایش تکثیر بلاست ها می باشد. وجود جهش های FLT3 با خطر عود مجدد بیماری مرتبط بوده و بیماران دارای مقدار بالایی از لوکوسیت هستند.
• جهش ایزوسیترات دهیدروژناز (IDH)
جهش های ژن ایزوسیترات دهیدروژناز 1 و 2 به صورت gain-of-function هستند که منجر به از دست رفتن عملکرد فیزیولوژیک آنزیم و بدست آوردن یک توانایی جدید در آن می گردد. آنزیم ها با ویژگی های جدید قادرند که α-ketoglutarate را به 2-hydroxyglutarate تبدیل کنند. جهش های IDH جز آنکوژن ها محسوب می شوند. جهش های متعددی در ژن IDH1 در آرژنین کدون 132 (R132)، R140 و R172 در حدود 15-20 درصد از مبتلایان به AML و 25-30 درصد از بیماران CN-AML مشاهده می شود. این جهش ها در افراد مبتلا با سنین بالا رایج تر هستند. جهش های ژن IDH به خصوص IDH1 با کاهش طور عمر بیمار مرتبط می باشند.
• جهش Ten-Eleven Translocation 2 (TET2)
جهش در ژن TET2 در حدود 9-23 درصد از بیماران مبتلا به سرطان AML یافت می گردد. TET2 آنزیمی است که عملکرد آن تبدیل 5-متیل سیتوزین (5mC) به 5-هیدروکسی متیل سیتوزین در DNA می باشد. این فرآیند نقش خیلی مهمی در مسیر متیلاسیون DNA ایفا می کند. جهشی که در ژن TET2 رخ می دهد به صورت Loss of function می باشد.
• جهش Runt-Related Transcription Factor (RUNX1)
نتایج مطالعات مختلف نشان داده اند که ژن RUNX1 نقش مهمی در مسیر خون سازی (hematopoiesis) دارد. محصول این ژن با نام پروتئین AML1 و یا CBFA2 ((core binding factor subunit α-2 شناخته می شود. ترانسلوکاسیون ژن RUNX1 روی کروموزوم 21 با ژن های ETO/MTG8/RUNX1T1 روی کروموزوم 8 با موقعیت 8q22 رخ داده و پروتئین فیوژن AML-ETO و یا t(8;21)(q22;q22) AML را تولید می کند. علاوه بر ترانسلوکاسیونی که در ژن RUNX1 رخ می دهد، جهش های دیگری نیز در حدود 5 تا 13 درصد از افراد مبتلا به AML یافت می گردد. این جهش ها اغلب با تریزومی 13، تریزومی 21، نبود NPM1 همراه می باشد. به طور کلی، جهش های ژن RUNX1 با مقاومت فرد مبتلا به داروهای استاندارد مسیر درمان بیماری AML همراه است و منجر به کاهش طول عمر فرد می گردد.
• جهش CCAAT Enhancer Binding Protein α (CEBPA)
بروز جهش در ژن CEBPA در حدود 6% تا 10% از مبتلایان AML و 15% تا 19% از CN-AML یافت می گردد که همراه با del(9q) می باشد. CEBPA یک فاکتور رونویسی ضروری است که بیان ژن در حین روند خون سازی را کنترل می کند. در بیماری AML، جهش های CEBPA اغلب به صورت دوگانه هستند که شامل ترکیبی از جهش -N ترمینال و ژن bZIPمی باشد.
• جهش Additional Sex Comb-Like 1 (ASXL1)
تغییرات و جهش هایی که در ژن ASXL1 رخ می دهند به صورت loss-of-function است که در حدود 5% تا 11% از مبتلایان به بیماری AML یافت می گردد. عملکرد پروتئینی که این ژن کد می کند هنوز به درستی مشخص نشده است اما پیشنهاد شده که می تواند در مسیرهای تنظیم اپی ژنتیکی دخالت داشته باشد. نرخ شیوع جهش های ژن ASXL1 حدود 2/16% در بیماران مسن بالای 60 سال بیشتر از افراد زیر 60 سال و جوانتر می باشد. در بیماران مسن، جهش ASXL1 با t(8:21)، NPM1 wild type، نبود FLT3-ITD و CEBPA جهش یافته همراه می باشد.
• جهش Mixed lineage Leukemia (MLL)
ژن MLL که بر روی کروموزوم 11 با موقعیت 11q23 واقع شده است یک پروتئین با فعالیت هیستون متیل ترانسفرازی را کد می کند که در مدیفیکاسیون های کروماتین دخیل است. ترانسلوکاسیون هایی که بر MLL تاثیر می گذارند منجر به بروز لنفوبلاستیک حاد تهاجمی (aggressive acute lymphoblastic) و لوکمی میلوئید (myeloid leukemia) شده و با بیان بیش از حد ژن HOX مشخص می گردد. علاوه بر ترانسلوکاسیون، مضاعف شدگی های جزئی پشت سرهم (partial tandem duplication) در ژن MLL (MLL-PTD) در بزرگسالان با بیماری de novo CN-AML و موارد AML با تریزومی 11 نیز مشاهده می گردد.
• جهش در Tumor Protein p53 (TP53)
جهش در ژن TP53 در حدود 8% تا 14% از مبتلایان AML یافت می شود. این جهش ها و حذف ها (deletion) اغلب با بروز کاریوتایپ پیچیده (%69 از افراد بیمار) همراه هستند. بیمارانی که دارای این جهش هستند در مقابل داروهای شیمی درمانی مقاومت نشان می دهند.
• جهش c-KIT
گیرنده تایروزین کیناز KIT یک پروتئین ترانس ممبران با وزن 145 kDa است که وجود آن جهت انجام خون سازی ضروری می باشد. این جهش بسیار نادر است و در کمتر از 5 درصد مبتلایان به AML مشاهده شده است. با این وجود، این جهش در حدود 22% تا 29% از موارد جهش های CBF وجود دارد. جهش در این ژن با کاهش طول عمر بیمار و وخامت بیماری AML همراه است به خصوص زمانی که در بیماران جهش t(8;21)(q22;q22) وجود داشته باشد.
• Splicing Factor Gene Mutations and Mutations in Cohesion Complex Members
این دسته از جهش ها اغلب به عنوان یک جهش بنیان گذار در نظر گرفته شده و مرتبط با شرایط pre-leukemic مانند MDS می باشد. شایع ترین ژن های گزارش شده در این زمینه شامل SF3B1، U2AF1، SRSF2 و ZRSR2 هستند. در بیمارانی که به تازگی به بیماری AML مبتلا شده اند جهش های اسپلایوزوم از جمله U2AF1، F3B1، SRSF2 و یا ZRSR2 به عنوان یک فاکتور پاتوژنومیک AML ثانویه در نظر گرفته می شوند. جهش های کمپلکس کوهسین سوماتیک در حدود 20% از بیماران MDS با خطر ریسک بالا و AML ثانویه مشاهده می شود.
روش های تشخیص بیماری AML
زمانی که نتایج آزمایش خونی فردی طبیعی نباشد به عنوان مثال بالا بودن غیرنرمال سطح گلبول های سفید خون و یا تعداد خیلی کم سلول ها در نمونه خون، پزشک مشکوک به بیماری AML خواهد شد که به منظور تشخیص دقیق تر آزمایشات تکمیلی را تجویز خواهد کرد. که در ادامه به معرفی تکنیک های ملکولی و روش های مختلف می پردازیم.
• نمونه برداری از مغز استخوان
در این حالت از مغز استخوان بیوپسی گرفته شده و به منظور بررسی وجود سلول های سرطانی به آزمایشگاه ارسال می شود.
• فلوسایتومتری
فلوسایتومتری (FCM)، یکی از تست های آزمایشگاهی است که به منظور ارزیابی سلول ها و ویژگی های آنها مورد استفاده قرار می گیرد. در این تکنیک نمونه ها به شکل مایع به دستگاه تزریق می گردد. اساس کار این دستگاه تاباندن اشعه لیزر به سلول ها و مشخص کردن ویژگی های آن بر اساس پراکنش اشعه می باشد. از جمله کاربردهای این روش می توان به موارد زیر اشاره کرد که عبارتند از:
• شمارش سلول ها
• طبقه بندی انواع سلول های موجود در نمونه
• مشخص کردن ویژگی ها سلول ها
• شناسایی میکروارگانیسم هایی مانند باکتری، قارچ ها و مخمرها
• پیدا کردن بیومارکرها
امروزه FCM به یک ابزار قدرتمند در زمینه تعیین ایمنوفنوتایپینگ (immunophenotyping) تبدیل شده و نقش مهمی در تشخیص انواع لوسمی ایفا میکند. فلوسیتومتری میتواند در شناسایی سریع جمعیت سلولی، مشخص کردن فنوتیپ آنها، طبقه بندی رده سلولی (lineage classification) و یا محدود کردن فهرست افتراقی را مورد استفاده قرار گیرد. همچنین از این تست در ارزیبی کلونالیته یک جمعیت سلول B یا T بالغ و تعیین پلوئیدی بودن DNA نیز کارآمد است که برای تشخیص پیش بینی (predicting) و یا پیش آگهی (prognosis) نیز بسیار مفید می باشد. برقراری ارتباط بین مورفولوژی، اطلاعات بالینی و گاهی اوقات یافته های سیتوژنتیک/مولکولی برای تفسیر دقیق نتایج فلوسیتومتری همیشه ضروری است.
در اغلب بیماران مبتلا به AML، اغلب مارکرها یا نشانگرهای خاصی را بیان می کنند که در زمینه تشخیص از اهمیت بالایی قرار دارند. نمونه هایی که در این تست می توان از آنها استفاده کرد شامل نمونه مغز استخوان، مایع مغزی نخاعی، serous effusions، آسپیراسیون با سوزن ظریف (fine needle aspirations – FNAs) و بافت فیکس نشده تازه می باشد. آماده سازی نمونه برای انجام تست توسط FCM با توجه به نوع نمونه و آنتی ژنی که باید مورد بررسی قرار گیرد متفاوت است.
سوسپانسیون سلولی تولید شده از طریق خرد کردن بافت باید فیلتر شود تا ذرات بزرگی که ممکن است لوله سیتومتر را مسدود کرده و یا اینکه به طور غیر اختصاصی به آنتی بادی ها متصل شوند، حذف گردند. در هر نمونه مقدار زیادی PB یا خون محیطی یا گلبول های قرمز خون وجود دارد که باید از طریق فرآیند لیز با استفاده از محلول کلرید آمونیوم در مرحله آماده سازی نمونه برای انجام فلوسیتومتری حذف شوند.
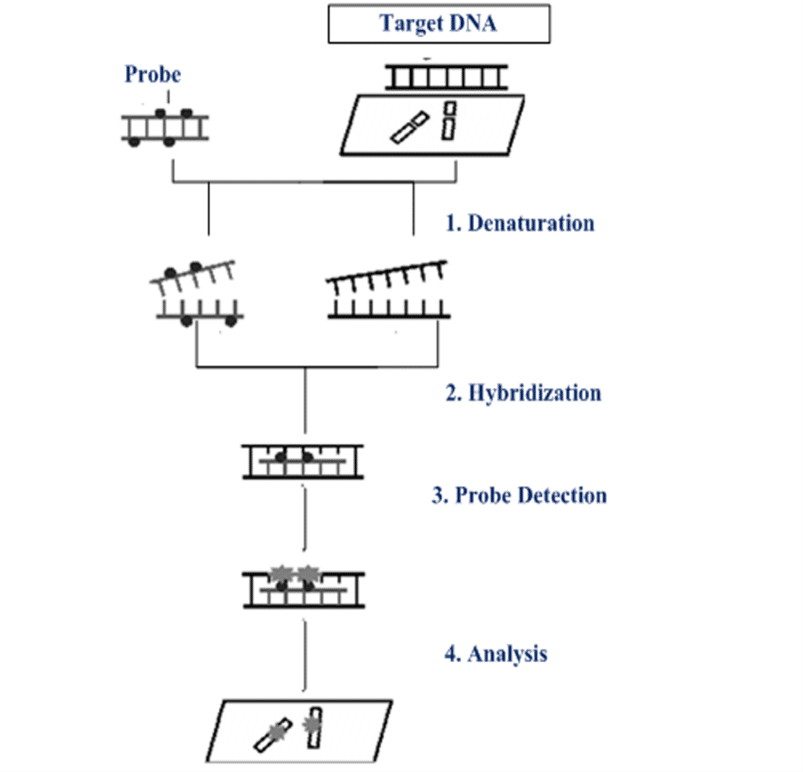
• FISH
تکنیک FISH یکی از روش های متداول سیتوژنتیکی در بررسی ناهنجاری های کروموزومی است که در آن از پرایمر های فلورسنت استفاده می شود. این پرایمرها نواحی خاصی درون ژنوم را شناسایی کرده و با حساسیت بالاتری نسبت به کاریوتایپ به آنها متصل می شوند. از این رو، روش FISH به عنوان یکی از تکنیک های کارآمد در زمینه تشخیص بیماری AML مورد استفاده قرار می گیرد. امروزه کیت های تجاری مختلفی به منظور بررسی جهش های مختلف مرتبط با بیماری AML در دسترس هستند که پروب های آنها با دقت بالایی ناهنجاری های ساختاری کروموزوم ها را ارزیابی می کنند.
• کاریوتایپ
کاریوتایپ تصویری از مجموعه کروموزوم های یک موجود زنده است. این روش یکی از معتبرترین روش های تشخیص بیماری AML به منظور بررسی ناهنجاری های ساختاری و عددی کروموزوم ها می باشد. از جمله ناهنجاری های ساختاری می توان به مواردی مانند جهش های حذف (deletion)، مضاعف شدگی (duplication)، جابه جایی های (translocation) متعادل و نامتعادل، درج (insertion)، وارونگی (inversion) اشاره کرد. در روش کاریوتایپ با بررسی کروموزوم های متافازی می توان به وجود ناهنجاری های سیتوژنتیکی در بیماران پی برد. حدود 55% از افراد بزرگسال مبتلا به AML دارای کاریوتایپ غیر معمولی هستند. حدود 10تا 12 درصد از بیماران AML در برخی موارد کاریوتایپ پیچیده (CK) با بیش از 3 ناهنجاری را نشان می دهند که مرتبط با پیش آگاهی (prognosis) ضعیف می باشد. شایع ترن ناهنجاری یافت شده در کاریوتایپ پیچیده (CK)، ناهنجاری نامتعادلی است که منجر به از دست رفتن بخشی از کروموزوم های 7q، 5q و 17p می گردد.
• Real-Time PCR
از دیگر روش های تشخیص ملکولی در بحث تشخیص بیماری AML می توان به روش Real-Time PCR اشاره کرد. واکنش Real-Time PCR یا تکنیک PCR کمی (Quantitative PCR or qPCR)، نوعی Multiplex PCR است که امکان مانتیور کردن و مشاهده پیشرفت واکنش را برای کاربر فراهم می کند. از مزایای این روش می توان به سرعت و دقت و حساسیت بالای آن اشاره کرد که باعث شده ابزاری کلیدی در تشخیص بیماری ها بشمار رود.
یکی از تکنیک های تشخیصی ملکولی کارآمد در زمینه سرطان AML، Real-Time PCR است که با کمک آن می توان رونوشت های فیوژن PML-RARA را شناسایی کرد. این امر در زمینه کنترل بیماری در افراد مبتلا از اهمیت بالایی برخوردار است. در این روش می توان با استفاده از پرایمرهای مختلف رونوشت های bcr1، bcr2 و bcr3 را شناسایی کرد، در کیت تشخیص بیماری AML طراحی شده توسط شرکت تریتاژن از سه کیت مختلف جهت تشخیص این رونوشت های متفاوت استفاده می شود. باید توجه داشته باشید که با توجه به مشابهت نقاط شکستگی درbcr1 و bc2می توان با استفاده از پرایمرهای مشابه وجود رونوشت ها را مشخص کرد.
در این تکنیک ابتدا با کمک آنزیم رونوشت بردار معکوس از روی m.RNA های موجود c.DNA ساخته شده و بعد طی واکنش PCR این قطعات سنتز می شوند. کمی سازی (Quantification) معمولاً با ساخت منحنی های استاندارد برای هر کدام از اجزای PCR با استفاده از یک سری استانداردهای پلاسمیدی با غلظت شناخته شده انجام می شود که حاوی رونوشت فیوژن یا همان ژن مرجع (reference gene) مدنظر است. سپس رونوشت های فیوژن و تعداد نسخه های ژن مرجع در نمونه های بیمار با استفاده از این منحنی های استاندارد محاسبه میشوند.
روش های درمان بیماری AML
امروزه روش های درمانی مختلفی برای سرطان AML در دسترس هستند که شامل شیمی درمانی، پرتو درمانی، پیوند سلول های بنیادی آلوژنتیک و روش درمان هدفمند (Targeted therapy) می باشد. به طور کلی، درمان بیماری AML در دو مرحله مختلف انجام می شود که عبارتند از:
1) درمان القایی بهبودی (Remission industry therapy): اولین گام در درمان سرطان AML از بین بردن سلول های سرطانی در خون و مغز استخوان فرد بیمار است که در این مرحله انجام می شود.
2) درمان پس از بهبودی (post remission therapy): در این مرحله از درمان تلاش می شود تا سلول های باقی مانده از لوکمی که ممکن است غیرفعال بوده و در مراحل بعدی فعال شوند را از بین ببرند. در صورتی که این مرحله به درستی انجام نشود، خطر عود مجدد بیماری در فرد مبتلا وجود خواهد داشت.
منابع علمی
https://www.ncbi.nlm.nih.gov/books/NBK507875
https://www.nature.com/articles/bcj201650
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4810104
https://www.mdpi.com/2077-0383/5/3/33
https://sci-hub.st/10.1038/nrdp.2016.10
https://acsjournals.onlinelibrary.wiley.com/doi/epdf/10.1002/cncr.22233
https://onlinelibrary.wiley.com/doi/10.1002/ajh.26822
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7004512
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8467861
https://www.ncbi.nlm.nih.gov/books/NBK586209

