سایتومگالو ویروس (CMV)
سایتومگالو ویروس انسانی (HCMV) که به طور رسمی با عنوان ویروس هرپس انسانی 5 (HHV5) نیز معرفی می گردد، یکی از حدود 100 مورد ویروس هرپس (herpes virus) شناخته شده می باشد. این نوع ویروس CMV در زیر گروه هرپس بتا (beta-herpesvirus) طبقه بندی می گردد. به طور کلی، ویروس CMV از شیوع بالایی در جهان برخوردار است و نرخ توزیع آن در مناطق مختلف متفاوت می باشد. در صورتی که فردی به ویروس CMV مبتلا باشد، می تواند آن را از طریق مایعات بدن مانند خون، بزاق دهان، ادرار، اشک، شیر مادر، مایع منی، دریافت عضو پیوندی و مایعات واژن به فرد دیگر منتقل کند. ویروس CMV سلول های مختلف انسانی از جمله فیبروبلاست ها، سلول های اپیتلیال، سلول های اندوتلیال، سلول های ماهیچه ای صاف و مونوسیت ها را تحت تاثیر خود قرار داده و آلوده می کند.
عفونت CMV اغلب با غدد بزاقی مرتبط می باشد. عفونت اولیه HCMV عموماً بدون علامت است و علائم بالینی خفیفی را در افراد سالم ایجاد می کند. با این حال، در افراد دچار نقص در سیستم ایمنی، می تواند یک پاسخ ایمنی شدید ایجاد کرده و عوارض مختلفی را در بر داشته باشد. در صورت ضعیف بودن سیستم ایمنی (مانند ابتلا به ویروس HIV) اندام های مختلفی مانند ریه، کبد، مری، معده، چشم ها و روده درگیر شده و علائم بیماری بر آنها تاثیر منفی خواهد داشت. CMV قادر است که هم به شکل مزمن (chronic) و هم به صورت نهفته (latent) میزبان را آلوده کند. شایع ترین نشانه های ابتلا به ویروس CMV در افراد عبارتند از:
• احساس خستگی
• تب داشتن
• مشاهده راش های پوستی
• گلودرد
• تورم غدد بزاقی
CMV شایع ترین علت از دست دادن قدرت بینایی در بین مبتلایان به ویروس HIV است حتی در صورتی که فرد تحت درمان با داروهای ضد رتروویروسی فعال باشد. HCMV پاسخ های ایمنی میزبان را با مکانیسم های ایمنی ذاتی آغاز می کند. این مکانیسم ها شامل تولید سایتوکاین های التهابی ناشی از اتصال ویروس به سلول و القای سلول NK می باشد که در نتیجه منجر به تولید آنتی بادی ها و شروع پاسخ های سلول های T-cell CD8+ و CD4+ می گردد.
انواع ویروس CMV
عفونت CMV انواع مختلفی دارد که عبارتند از:
• مادرزادی (Congenital): در این حالت نوزاد در دوران جنینی ویروس را از مادر خود دریافت نموده است. اغلب این نوزادان علائم مختلفی مانند زایمان زودرس، زردی یا یرقان، تشنج، ناشنوایی، وزن کم در زمان تولد، التهاب کبد (هپاتیت) و کبودی های پوستی را بروز می دهند.
• اولیه (primitive): این نوع زمانی اتفاق می افتد که فرد برای اولین بار به عفونت CMV مبتلا می شود. در اغلب موارد فرد علائمی را در این مرحله ندارد اما در برخی افراد نشانه هایی شبیه مونونوکلئوز بروز می یابد.
• فعال شدن مجدد (Reactivation): در این حالت فرد ویروس CMV را به شکل نهفته در بدن خود دارد و با تضغیف سیستم ایمنی این عفونت مجددا فعال می گردد. این حالت اغلب در افرادی که مبتلا به HIV هستند یا در حین گذراندن شیمی درمانی یا انجام عمل پیوند عضو باشند مشاهده می شود.
ساختار ژنوم ویروس
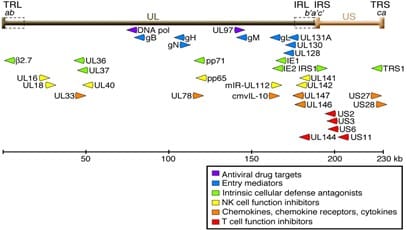
ژنوم ویروس CMV به شکل دو رشته از جنس DNA (dsDNA) می باشد که اندازه آن تقریبا 240 kb بوده و بزرگترین ژنوم را در بین ویروس های beta-herpesvirus دارا است. در ساختار ژنوم این ویروس دو نوع قطعه مختلف با نام های unique long (UL) و unique short (US) وجود دارد که هر کدام توالی های معکوس (terminal and internal inverted repeats) TRL، IRL، TRSو IRS احاطه (flanked) شده اند. بخش مرکزی ناحیه UL شامل خوشه هایی از ژن های مرکزی (clusters of core genes) است که دارای همولوگ در سایر ویروس های هرپس هستند. از جمله این ژن ها می توان به مواردی از جمله ژن DNA پلیمراز، گلیکوپروتئین B (gB) و گلیکوپروتئین H (gH) اشاره کرد. سایر ژن های ژنوم CMV عمدتا تنها در گروه beta-herpesvirus یافت شده و یا منحصرا در HCMV وجود دارند.
سیستم نام گذاری اغلب ژن های CMV بر اساس موقعیت آنها در ژنوم می باشد، به عنوان مثال ژن UL54 پنجاه و چهارمین ژن در ناحیه UL است. اغلب ژن های ویروس CMV کد کننده پروتئین بوده و بیش از 200 محصول را تولید می کنند. با این وجود، برخی از آنها RNA های غیر کننده ای (noncoding RNAs) را می سازند که شامل حدودا 14 عدد miRNA می باشد. از اصلی ترین lncRNA های کد شده توسط ژنوم CMV می توان به RNA1.2، RNA2.7، RNA4.9 و RNA5.0 اشاره کرد.
بیان ژن های ویروسی بسیار پیچیده است و از طریق برهمکنش بین پروتئین های کد شده ویروسی و فاکتورهای سلولی میزبان تنظیم می گردد. چرخه سلولی تکثیر CMV به سه فاز مختلف تقسیم می شود که عبارتند از: فاز اولیه فوری یا IE (Immediate early phase)، فاز اولیه یا E (Early phase) و فاز تاخیری یا L (Late phase). mRNA های مرحله IE رونوشت هایی هستند که در طی ساعات اولیه پس از ابتلای فرد به عفونت CMV تولید می شوند. پروتئین هایی که توسط mRNA های IE تولید می شوند در برقراری تعادل بین ژن های ویروسی و میزبان نقش مهمی را ایفا می کنند. پروتئین هایی که در مرحله E سنتز می شوند شامل پروتئین های دخیل در همانندسازی DNA و سایر پروتئین های ساختاری است. محصولات ژنی مرحله L اغلب 72 ساعت پس از ابتلای فرد به عفونت CMV رونویسی شده که شامل پروتئین های ساختاری، پروتئین های دخیل در تجمع و خروج ویریون ها می باشد.
مورفولوژی ویریون و اجزای آن
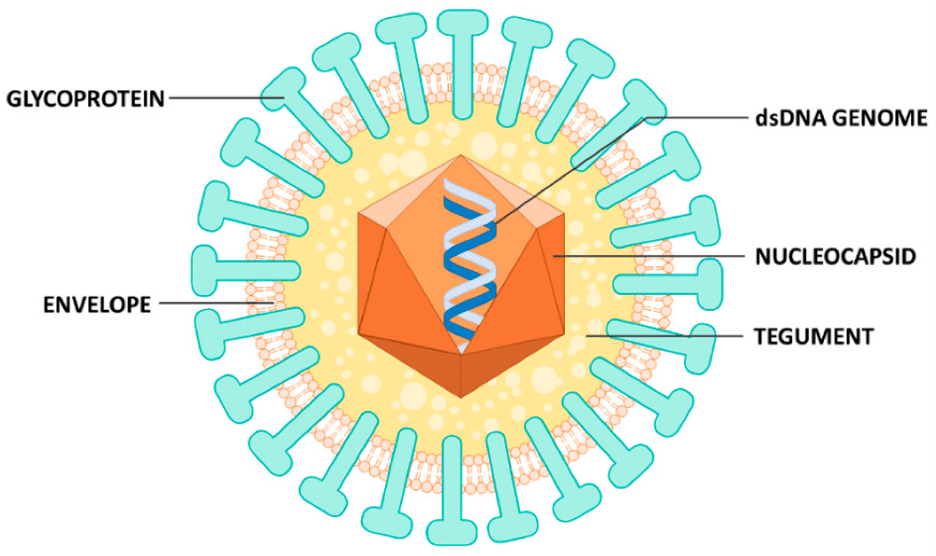
ویروس CMV یکی از ویروس های غشادار با ژنوم DNA دو رشته است و از سه جز مختلف تشکیل شده است که شامل کپسید بیست وجهی یا ایکوسادرال (icosahedral capsid)، لایه tegument و یک غشای لیپیدی خارجی (outer lipid envelope) می باشد. اطلاعات موفولوژیک ویروس CMV از طریق بررسی آن با میکروسکپ های الکترونی (EM) بدست آمده است. از لحاظ کلاسیک زمانی که تصویر برداری از این ویروس با EM انجام می شود، چگالی الکترونی بالایی (highly electron-density) دارد. کپسید بیست وجهی شامل 162 زیرواحد کپسومری است که با تقارن icosahedral در کنار هم قرار گرفته و ژنوم ویروس را در بر می گیرد. کپسید ویروس CMV توسط لایه ای به نام tegument احاطه شده است.
tegument یک لایه غنی از پروتئین با چندین domain است که توسط لنفوسیت های T در زمان پاسخ به عفونت ها مورد هدف شناسایی قرار می گیرد. از جمله پروتئین های این لایه می توان به فسفوپروتئین pp65 با وزن 65 kDa اشاره کرد که به اختصار به pp65 گفته می شود. بعد از لایه tegument غشای خارجی (outer envelope) قرار دارد و از اجزای مختلفی تشکیل شده است. غشای ویروس CMV شامل چندین گلیکوپروتئین کد شونده توسط ژنوم ویروس و کمپلکس های پروتئین مختلف مانند gB، gM/gN و gH/gL/gO است. در افراد CMV مثبت، پاسخ ایمنی بروز می یابد که در آن آنتی بادی ها به این گلیکوپروتئین ها متصل می شوند. از اینرو، فرم های نوترکیب این پروتئین ها به عنوان کاندید جهت طراحی دارو مورد توجه قرار گرفته اند.
نحوه ورود ویروس به سلول میزبان
گلیکوپروتئین های موجود در غشای ویروس، علاوه بر اینکه در بروز پاسخ ایمنی همورال موثرند، نقش مهمی نیز در اتصال و ورود CMV به درون سلول میزبان را ایفا می کنند. CMV جهت ورود به درون سلول میزبان از دو نوع مکانیسم خاص و متمایز به نام های فیوژن غشایی (membrane fusion) و اندوسیتوز (endocytosis) استفاده می کند. نوع روش ورود ویروس به سلول به نوع سلول میزبان بستگی دارد. ورود ویروس به سلول های اپی تلیال و اندوتلیال از طریق اندوسیتوز وابسته به PH صورت می گیرد اما در خصوص سلول های فیبروبلاست به شکل غیر اندوسیتوزی و مستقل از PH می باشد.
اعتقاد بر این است که ورود ویروس CMV به درون سلول های فیبروبلاست از طریق اتصال gB ویریون با یکی از گیرنده های سطح سلولی (گیرنده هنوز ناشناخته است) آغاز می شود. سپس با غشای سلول ادغام (fusion) خواهد شد که انجام این کار نیازمند کمپلکس تریمر متشکل از سه گلیکوپروتئین gH، gL و gO (UL75/UL115/UL74) است. کمپلکس تریمر با گیرنده α فاکتور رشد مشتق شده از پلاکت (platelet-derived growth factor receptor α) یا به اختصار PDGFRα تعامل داشته و منجر به فیوژن غشا مستقل از PH می گردد.
در مقابل، ورود CMV به سلول های اندوتلیال و اپی تلیال نیازمند کمپلکس پنتامر پروتئینی gH، gL و سه پروتئین دیگر (UL128/UL130/UL131) است که توسط ناحیه ای از ژنوم CMV با موقعیت ژنی UL128-131 کد می شوند. این کمپلکس با نوروپیلین-2 (Nrp2) از طریق اندوسیتوز وابسته به pH پایین در سلول های اپیتلیال و اندوتلیال تعامل دارد. علاوه بر این، نتایج برخی مطالعات نشان می دهند که CD147، CD46 و OR14I1 به عنوان عوامل ورود اپیتلیال عمل می کنند. فاکتور رشد TGFβRIII (transforming growth factor β receptor type 3) و NRG2 (neuregulin-2) نیز در افزایش احتمال ورود ویریون ها به درون سلول های فیبروبلاست نفش مهمی را ایفا می کنند.
پاسخ ایمنی بدن به ورود ویروس CMV
به طور کلی، ویروس CMV قادر است طیف وسیعی از سلول ها را هدف خود قرار داده و آلوده کند. در افراد سالم این ویروس تکثیر خود را از اپیتلیوم مخاطی آغاز کرده و پس از آن مونوسیت های و سلول های CD34+ را آلوده می کند که منجر به ایجاد عفونت نهفته در فرد می گردد. پس از تمایز مونوسیت های آلوده به HCMV به ماکروفاژها، عفونت ویروسی آغاز می شود. در ادامه به معرفی سیستم عای ایمنی ذاتی و تطبیقی پرداخته خواهد شد.
1) ایمنی ذاتی (Innate Immunity)
در زمان ورود ویروس CMV به سلول ها، ابتدا ویریون ها توسط میزبان شناسایی شده و سیستم ایمنی ذاتی (innate immunity) که اولین خط دفاعی میزبان در مقابل عوامل بیگانه است، فعال می گردد. این نوع سیستم دفاعی شامل سیتوکین های التهابی، اینترفرون نوع I (IFN) و تنظیم مثبت (upregulation) CD80 و CD86 است. این مرحله برای محدود کردن گسترش پاتوژن ها و شروع پاسخ ایمنی تطبیقی (adaptive immune response) ضروری می باشد. تحریک مسیر NF-κB و تولید سیتوکین های التهابی مانند اینترلوکین-6 (IL-6) و TNF-α به وسیله تعامل (interaction) بین گلیکوپروتئین های پوششی ویروسی gB و گلیکوپروتئین gH با مولکول های حسگر سیستم ایمنی به نام TLR2 (toll-like receptors 2) ایجاد می شود.
این نوع سیتوکین های التهابی قادر به تحریک سلول های فاگوسیتوز کننده مانند سلول های دندریتیک (dendritic cells) هستند که توانایی از بین بردن سلول های آلوده به ویروس CMV را دارند. در محل های اولیه آلوده به ویروس CMV، سلول های NK فعال شده تا از طریق آزاد کردن پروتئین های سیتوتوکسیک، سلول های آلوده به ویروس CMV را از بین ببرند. نتایج مطالعات مختلف نشان می دهند که سلول های NK از طریق القای IFN-β و ترشح IFN-γ در سلول های آلوده مانع از انتقال ویروس CMV در سلول های اپیتلیال، اندوتلیال و فیبروبلاست می شوند. سلول های NK از اجزای اصلی سیستم ایمنی هستند که به وسیله تولید سیتوکین ها در بروز پاسخ های ایمنی تطبیقی و بلوغ سلول های t-cells شرکت می کنند.
2) سیستم ایمنی تطبیقی (Adaptive Immunity)
این نوع سیستم ایمنی در کنترل عفونت HPV دخالت دارد که از طریق دخالت دادن پاسخ های ایمنی همورال و سلولی، قوی ترین واکنش ها را در مقابل عوامل پاتوژن ایجاد خواهد کرد. سیستم ایمنی تطبیقی در مدیریت کارآمد عفونت اولیه بدن به ویروس CMV از اهمیت بالایی برخوردار است که در نهایت وارد مرحله نهفته می گردد.
در زمان عفونت اولیه سلول های به ویروس CMV، آغاز یک پاسخ ایمنی قوی برای کنترل عفونت بسیار مهم می باشد. نتایج بسیاری از تحقیقات، نقش سیستم همورال در محدود کردن انتشار ویروس و شدت CMV از طریق تولید آنتی بادی های مختلف بر علیه پروتئین های CMV، گلیکوپروتئین های غشایی و ژن های آن را گزارش کرده اند. اصلی ترین هدف در زمان عملکرد آنتی بادی ها gB است که در چسبندگی و تهاجم سلولی دخیل می باشد. از دیگر اهداف آنتی بادی ها می توان به gH اشاره کرد که در ادغام غشا سلول میزبان با غشای ویروس نقش دارد. بنابراین، سیستم ایمنی همورال نقش خیلی مهمی در زمینه کنترل عفونت و جلوگیری از انتشار ویروس CMV ایفا می کند.
با توجه به اینکه پاسخ ایمنی که به دلیل عفونت اولیه HCMV ایجاد می شود، نمی تواند آن را به طور کامل پاکسازی کند، T-cell ها از اهمیت بالاتری برخوردار خواهند بود. از مهم ترین T-cell ها می توان به CD4+ ، CD8+ و نوع γδ اشاره کرد که در محدود کردن تکثیر ویروس نقش کلیدی را ایفا می کنند. از اصلی ترین آنتی ژن هایی که CD8+ سلول های T در خصوص عفونت CMV به آن واکنش نشان می دهد می توان به IE1 (UL123)، IE2 (UL122) و pp55 (UL83) اشاره کرد. سلول های NK و γδ جز خاصی از ویروس CMV را هدف قرار نمی دهند بلکه قادرند سلول های اندوتلیال و فیبروبلاست های آلوده به HCMV را در پاسخ به یک استرس سلولی لیز کنند. سلول های γδ در بروز پاسخ ایمنی ضد عفونت ها و تومورها دخالت دارند. این سلول ها تحریک کننده تولید IFN-γ و TNF-α در زمان عفونت با ویروس CMV می باشند.
بیماری ها و عفونت های مرتبط با HCMV
تنها میزبان ویروس HCMV انسان است که می تواند بر اغلب اندام ها و بافت تاثیر بگذارد. عفونت های طولانی مدت به ویروس CMV می تواند عوارض جانبی مختلفی مانند التهاب مزمن، بیماری های قلبی و برخی سرطان ها در افرادی که سیستم ایمنی بدنشان ضعیفی است را به همراه داشته باشد. عفونت فعال این ویروس می تواند در بروز بیماری های مختلفی نظیر تصلب شرائین (arteriosclerosis)، کولیت (colitis)، ازوفاژیت (esophagitis)، سرطان کلورکتال (CRC)، سرطان معده (GC)، idiopathic thrombocytopenic purpura (IPT)، سرطان پروستات (PC)، نوروگلیوما (neuroglioma)، سرطان سینه، retinitis، لوپوس اریتماتوز سیستمیک (SLE)، مشکلات کبدی (هپاتیت) و اسکلروز سیستمیک (SSc) دخیل باشد. در افرادی که دارای نقص سیستم ایمنی (بیماری ایدز) هستند و یا بیماران دریافت کننده عضو پیوندی و جنین های در حال رشد خطر مرگ در اثر ابتلا به عفونت CMV افزایش می یابد.
بیماری نئوپلاستیک (Neoplastic diseases)
به طور کلی، اصطلاح نئوپلاسم به معنی رشد کردن غیرنرمال سلول های بدن یک فرد است و با نام تومور نیز شناخته می شود. بیماری های نئوپلاستیک به نواعی از بیماری ها اطلاق می گردد که در آنها تومور به وجود می آید. با وجود اینکه مکانیسم CMV در بروز بسیاری از سرطان ها نامشخص است اما نتایج برخی مطالعات نشان می دهد که این ویروس در تنظیم تومور نقش داشته و بر رشد سلول های سرطانی نیز تاثیر گذار است. به عنوان مثال، در تحقیقات مختلف مشاهده شده که در متاستازهای مغزی بیماران مبتلا به سرطان سینه و کلورکتال اولیه، ویروس HCMV از شیوع بالایی برخوردار است. علاوه براین، HCMV pUL123 و pUL122 که توسط ویروس HCMV کد می شوند در جلوگیری از مرگ سلولی گلیوبلاستوما و افزایش رگ زایی نقش مهمی دارند که در نتیجه منجر به بقا و رشد تومورهای گلیوباستوما خواهد شد.
بیماری های غیر نئوپلاستیک (Non-neoplastic diseases)
عفونت های مکرر و فعال ویروس CMV نقش حیاتی در القا و سرعت بخشیدن به واکنش های التهابی مزمن (chronic inflammatory) در ناحیه آئورت بیماران مبتلا به آنوریسم التهابی آئورت شکمی دارد. نتایج برخی مطالعات نشان داده است که ابتلا به ویروس CMV می تواند با افزایش خطر بروز لوپوس اریتماتوز سیستمیک (SLE) مرتبط باشد. در افراد مبتلا به SLE، سطح آنتی بادی های IgG و IgM که ضد CMV هستند و همچنین UL55، به مقدار قابل توجهی بالاتر از افراد سالم است.
مونونوکلئوز ناشی از ویروس CMV
عفونت مونونوکلئوز (Infectious mononucleosis) یا به اختصار IM، یکی از شایع ترین بیماری های عفونی ویروسی است که اغلب توسط ویروس اپشتین بار (EBV) ایجاد می گردد. دومین علت متداول در بروز بیماری IM در حدود 5 تا 16 درصد از مبتلایان، آلودگی به ویروس CMV می باشد. از جمله علائم ابتلا به مونونوکلئوز می توان به گلودرد و سردرد اشاره کرد که به مرور زمان بدتر می شوند. نتایج مطالعات مختلف نشان داده است که مبتلایان به CMV-IM اغلب مسن تر از افراد EBV-IM هستند. راه انتقال این بیماری نیز از طریق مایعات بدن مانند بزاق می باشد. در اغلب افراد مبتلا به IM لوزه ها و غدد لنفاوی گردن متورم و دردناک خواهند شد. دیگر نشانه های رایج IM عبارتند از:
• بالارفتن دمای بدن
• سفت شدن عضلات و احساس درد
• بروز کهیر
• احساس خواب آلودگی
• درد قفسه سینه
• سرفه
• زردی پوست صورت و سفیدی چشم ها
• تنگی نفس
روش های تشخیص ویروس CMV
امروزه به منظور تشخیص ویروس CMV در افراد از روش های مختلف سرولوژیکی و ملکولی استفاده می شود که در ادامه هر یک از این روش ها معرفی خواهند شد.
• تست های سرولوژیکی
آزمایش های سرولوژیک به انواعی از روش های تشخیصی گفته می شود که در آن آنتی بادی های مرتبط ویروس CMV مانند IgM و IgG مورد بررسی و شناسایی قرار می گیرند. تست الیزا (ELISA) یا enzyme-linked immunosorbent assay از جمله رایج ترین آزمایشات سرولوژیک جهت اندازه گیری آنتی بادی های CMV در افراد بیمار می باشد. این تست سنجش ایمنولوژیک قیمت پائین و دقت بالایی دارد که باعث شده در بحث تشخیص بیماری های ویروسی (مانند CMV و HIV)، آزمایشات بارداری و اندازه گیری سطح ترشح هورمون ها به شکل گسترده ای مورد استفاده قرار گیرد. بسته به اینکه آنتی بادی یا آنتی ژن در این تست مورد بررسی قرار گیرد، آزمایش الایزا انواع مختلفی خواهد داشت.
در صورتی که آزمایش CMV IgG فرد مثبت باشد، نشان دهنده آلوده بودن به عفونت CMV است اما زمان ابتلای بیمار را مشخص نخواهد کرد. این تست برای افراد بالای 12 ماه کخ دیگر آنتی بادی های مادر در خون آنها وجود ندارد، مفید می باشد. از سوی دیگر، اندازه گیری CMV IgG از نمونه های جفت در جنین می تواند در زمینه تشخیص اولیه عفونت موثر باشد.
• Real-Time PCR
روش های PCR به خصوص Real-Time PCR از جمله تست های ملکولی رایج در زمینه تشخیص بیماری های ویروسی از جمله CMV و HIV به شمار می رود. نمونه مورد استفاده برای انحام این تست، خون محیطی بیماری می باشد. واکنش Real-Time PCR یا تکنیک PCR کمی (Quantitative PCR or qPCR)، نوعی Multiplex PCR است که امکان مانتیور کردن و مشاهده پیشرفت واکنش را برای کاربر فراهم می کند. از مزایای این روش می توان به سرعت و دقت و حساسیت بالای آن اشاره کرد که باعث شده ابزاری کلیدی در تشخیص بیماری ها بشمار رود.
به طور کلی در این تکنیک از دو گروه رنگ های فلورسنت استفاده می گردد که در گروه اول رنگ های فلورسنت متصل شونده به DNA دو رشته ای مانند سایبرگرین (SYBR Green) و اواگرین (EvaGreen) می باشد. این رنگ ها قادر به اتصال به هر DNA دو رشته ای در محیط واکنش به شکل غیر اختصاصی خواهند بود. در گروه دوم رنگ های فلورسنت به توالی های الیگونوکلئوتیدی به نام پروب متصل هستند بنابراین تنها می توانند به توالی های خاصی متصل شوند که شامل پروب های هیدورلیزی مانند پروب TaqMan و beacons می باشد.
پرایمر ها و پروب ها در این روشه برای ژن های مختلف MIE (Major Immediate Early) از ویروس CMV طراحی می شوند.
روش های درمان ویروس CMV
اخیرا داروهای مختلفی مانند Ganciclovir، foscarnet و cidofovir در زمینه پیشگیری و درمان عفونت CMV مورد استفاده قرار می گیرند. Ganciclovir یک آنالوگ گوانوزین است که پس از فسفوریلاسیون توسط کیناز CMV UL97، به عنوان یک پایان دهنده زنجیره در طول تکثیر DNA ویروسی عمل می کند. علاوه بر این، داروی cidofovir آنالوگ نوکلئوزید مونوفسفات و foscarnet نیز آنالوگ پیروفسفات هستند که نقش آنها مهار عملکرد آنزیم DNA پلیمراز می باشد.
نتایج تحقیقات مختلف نشان داده است که با وجود اینکه foscarnet به اندازه Ganciclovir موثر می باشد، اما عوارض مختلفی مانند سمیت کلیوی و عدم تعادل الکترولیتی را در بیماران به همراه خواهد داشت. داروی Ganciclovir دارای نوع خوراکی نیز می باشد که در زمینه درمان بیماری رتینیت می تواند به شکل موضعی در چشم بیمار ریخته شود. در مورد تمام این داروها ممکن است مقاوت دارویی در فرد مبتلا مشاهده شود. به عنوان مثال، جهش هایی که در UL97 کیناز ویروسی و یا DNA پلیمراز ویروس رخ می دهند منجر به بروز مقاومت نسبت به داروی Ganciclovir خواهند شد.
انجام تست های ژنتیکی می تواند در تعیین نوع جهش های مبتلایان و عدم بروز مقاومت دارویی در آنها موثر باشد. داروی imatinib که در زمینه درمان سرطان خون CML تجویز می گردد، نه تنها مهار کننده تایروزین کیناز است بلکه می تواند مانع از ورود ویروس CMV به درون سلول هایپ شود.
منابع علمی
https://www.nature.com/articles/s41579-021-00582-z
https://www.ncbi.nlm.nih.gov/books/NBK459185
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6431500
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7498621
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3869401
https://www.frontiersin.org/articles/10.3389/fgene.2019.00616/full
https://link.springer.com/article/10.1007/s11357-020-00170-8
https://www.frontiersin.org/articles/10.3389/fimmu.2021.730765/full
https://www.jci.org/articles/view/45449
https://systematicreviewsjournal.biomedcentral.com/articles/10.1186/s13643-022-02004-4
https://bmcpublichealth.biomedcentral.com/articles/10.1186/s12889-022-13971-7

