لوسمی میلوئید مزمن (CML)
بیماری لوسمی میلوئید مزمن (Chronic myeloid leukemia) یا به اختصار CML، یکی از انواع سرطان خون یا لوکمی است که با تولید بیش از حد سلول های میلوئیدی نابالغ و بالغ در خون محیطی (peripheral blood)، مغز استخوان و طحال مشخص می شود. این اختلال کلونال بدخیم (malignant clonal disorder) سلول های بنیادی خونساز (hematopoietic stem cells) نه تنها منجر به افزایش تعداد سلول های میلوئید بلکه سلول های اریتروئید و پلاکت ها در خون محیطی و هایپرپلازی میلوئید (myeloid hyperplasia) در مغز استخوان می گردد. به طور کلی، این بیماری بر خون محیطی و مغز استخوان تاثیر می گذارد. این بیماری علائم مختلفی در افراد ایجاد می کند که برخی از شایع ترین آنها عبارتند از:
• تب داشتن
• احساس خستگی
• ضعف کردن
• تعریق شبانه
• احساس سیری و پر بودن حتی بدون غذا خوردن
• کاهش وزن بدون دلیل
• درد استخوان ها
• بی اشتهایی
• خونریزی های مکرر
• نفس های کوتاه کشیدن (dyspnea)
نرخ شیوع این بیماری حدود 1 الی 2 نفر در هر 100000 بزرگسال است، تخمین زده شده که سالانه 8450 مورد جدید مبتلا به CML در آمریکا تشخیص داده شده و حدود 1080 نفر بر اثر ابتلا به آن فوت می کنند. در اغلب افراد مبتلا بیماری در مرحله مزمن اولیه (CML-CP) تشخیص داده می شود که با استفاده از گسترش سلول های میلوئیدی مشخص می گردد. در صورتی که CML در این مرحله تشخیص داده نشود و درمان مناسب دریافت نگردد، بیماری وارد فاز تسریع شده اولیه (Accelerated Phase) یا AP و بعد فاز تهاجمی انفجاری تر (blast phase) یا BP خواهد شد. در ادامه به توضیح این فازها پرداخته می شود.
هیستوپاتولوژی
فاز مزمن (Chronic Phase)
مرحله CP یا فاز مزمن، مرحله ای است که اسمیر خون محیطی، لوکوسیتوز را نشان می دهد و علت آن وجود گرانولوسیت ها در مراحل مختلف بلوغ است. سلول های بلاست کمتر از 2% گلبول های سفید را تشکیل می دهند. در این مرحله بالا رفتن سطح سلول های خونی ائوزینوفیل و بازوفیل ها شایع می باشد. مقدار پلاکت ها معمولا در محدوده ی طبیعی تا افزایش قابل توجه تغییر خواهد کرد اما مشاهده ترومبوسیتوپنی (Thrombocytopenia) یک اتفاق غیر متداول می باشد. بیوپسی و آسپیراسیون مغز استخوان، پرسلولی (hypercellularity) با تکثیر گرانولوسیتی مشخص و افزایش قابل توجه میلوسیت ها را نشان می دهد. با این وجود دیسپلازی قابل توجهی وجود ندارد. از سوی دیگر، پیش سازهای اریتروئید به طور قابل توجهی کاهش و نسبت میلوئید به اریتروئید افزایش می یابد. مگاکاریوسیت ها ممکن است کاهش یافته، طبیعی یا افزایش یافته باشند.
فاز تسریع یافته (Accelerated phase)
در مرحله ممکن است که اسمیر خون محیطی افزایش سطح بلاست های خون را با احتمال 10% تا 19% نشان دهد. آسپیراسیون مغز استخوان و بیوپسی تغییرات مشابه با فاز مزمن CML به همراه افزایش بلاست ها را نشان خواهد داد. از سوی دیگر امکان مشاهده تغییرات دیسپلاستیک در گرانولوسیت ها و افزایش رتیکولین و فیبروز کلاژن وجود دارد.
فاز بلاست (Blast crisis phase)
آسپیراسیون مغز استخوان و اسمیر خون محیطی افزایش 20 درصدی بلاست ها را نشان خواهد داد و یا اینکه تکثیر extramedullary این سلول ها مشاهده می گردد. در اغلب افراد مبتلا به بلاست هایی با تمایز میلوئید وجود دارد البته ممکن است لنفوسیت ها هم مشاهده شوند. وجود تکثیر Extramedullary در پوست، گره های لنفاوی، استخوان و سیستم عصبی مرکزی (CNS) بسیار متداول می باشد. فاز BC به شدت تهاجمی و غیرقابل درمان است. درصورتی که CML درمان نشود در عرض 3 تا 5 سال از یک فرم خفیف و قابل کنترل یا فاز مزمن (CP) به فاز تهاجمی و غیرقابل درمان بلاست (BC)، که مرحله نهایی این بیماری است پیشرفت خواهد کرد.
علت بروز بیماری CML
علت اصلی بروز بیماری لوسمی میلوئید مزمن (CML) وجود کروموزوم غیرطبیعی فیلادلفیاست (Ph) که از طریق ترانسلوکاسیون متعادل دوطرفه (balanced reciprocal translocation) بین کروموزوم های 9 و 22 t(9;22) (q34;q11) رخ می دهد. پیامد ملکولی این ترانسلوکاسیون ایجاد آنکوژن BCR-ABL1 است که منجر به تولید پروتئین کایمریک BCR-ABL1 با فعالیت کینازی (constitutive kinase activity) می گردد. نتایج مطالعات آزمایشگاهی مختلفی نشان می دهند که BCR-ABL1 انکوژن است و منجر به تکثیر سلول های لوسمیک و مهار آپوپتوز می گردد. آنکوژن فیوژن BCR-ABL1 در همه مبتلایان به CML، حدود 25% از مبتلایان به ALL و در برخی موارد در افراد مبتلا به AML یافت می گردد.
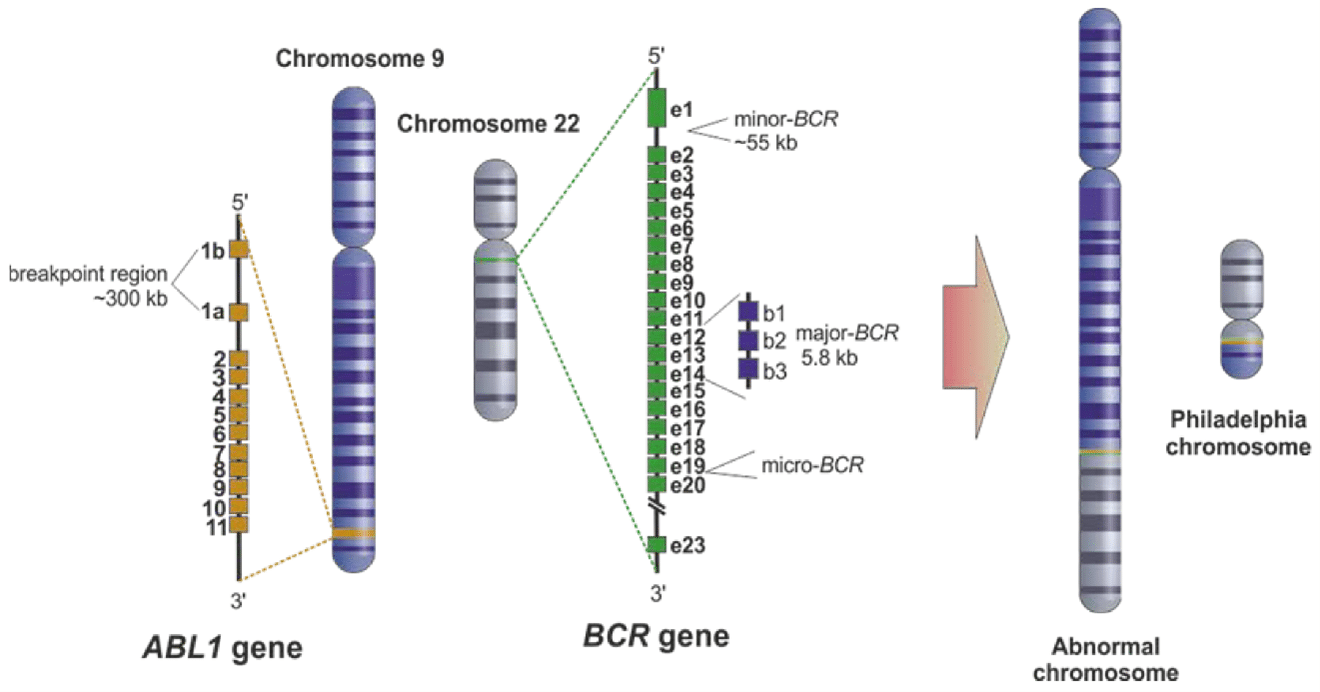
ژن ABL1، یک پروتوآنکوژن است که پروتئین تیروزین کیناز را کد کرده و در انواع فرآیندهای مختلف سلولی از جمله تقسیم سلولی، چسبندگی (adhesion)، تمایز و پاسخ به استرس نقش دارد. موقعیت این ژن 9q34 است و طول آن حدود 230 Kb می باشد. فعالیت پروتئین ABL1 به طور منفی توسط domain SH3 آن تنظیم می گردد. بنابراین بروز جهش حذفی در ناحیه کد کننده این دومین (domain) منجر به ایجاد یک انکوژن می شود. پروتئینی ABL1 دارای فعالیت اتصال به DNA (DNA-binding activity) است که توسط فسفوریلاسیون با واسطه CDC2 (CDC2-mediated phosphorylation) تنظیم شده و نشان دهنده عملکرد چرخه سلولی می باشد. ژن کد کننده این پروتئین به صورت فیوژن (fusion) با انواع مختلفی از ژن ها در لوکمی مشاهده می گردد اما رایج ترین آن t(9;22) است.
ژن BCR روی کروموزوم 22 با موقعیت 22q11 قرار گرفته با طول حدودا 135 Kb قرار دارد. این ژن دارای 23 اگزون می باشد. با وجود اینکه عملکرد پروتئین BCR-ABL1 در بسیاری از مطالعات مورد بررسی قرار گرفته است اما عملکرد پروتئین BCR طبیعی هنوز به طور دقیق مشخص نشده است. پروتئین BCR دارای فعالیت سرین/ترئونین کینازی است و یک پروتئین فعال کننده GTPase برای p21rac و سایر کینازها می باشد. تا امروز دو نوع رونوشت (Transcript) مختلف برای این ژن شناخته شده است.
انکوژن BCR-ABL1
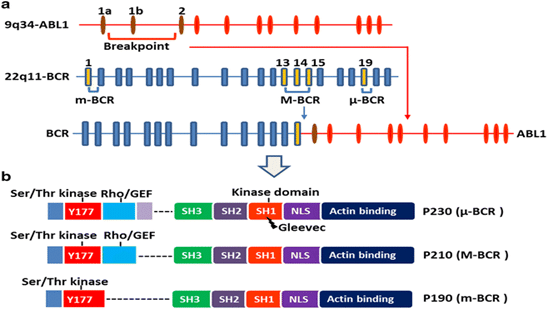
ژن ABL1 دارای دو اگزون اولیه به صورت آلترناتیو (alternative) با نام های 1a و 1b می باشد. شکست در ژن ABL1 در نواحی مختلفی از جمله بالادست اگزون Ib (upstream of exon Ib)، پایین دست اگزون Ia (downstream of exon Ia) و یا بین اگزون های Ia و Ib (شایع ترین حالت) رخ می دهد. در اکثر مبتلایان به CML و یک سوم افراد مبتلا به Ph+ B-ALL (Ph-positive B-cell acute lymphoblastic leukemia)، نقطه شکستگی در ژن BCR بین اگزون های e12 تا e16 است. طول این ناحیه 5.8 Kb است که به عنوان M-bcr (Major breakpoint cluster region) شناخته می شود.
ژن BCR دارای 23 عدد اگزون است که اگزون های 1′ و 2′ به شکل آلترناتیو (alternative) درون اولین اینترون واقع شده اند. 3 ناحیه اصلی که در این ژن دچار شکستگی می شوند شامل m-bcr، M-bcrو μ-bcrمی باشد. پیرایش متناوب (alternative splicing) باعث ایجاد نسخه های فیوژن با اتصالات b2a2 یا b3a2 شده و در نهایت یک پروتئین 210 KDa (p210BCR-ABL1) تولید می گردد. در حدود دو سوم از بیماران Ph+ B-ALL و در برخی موارد نادر از CML، شکستگی کروموزومی در ژن BCR بین نواحی اگزون های e2′ و e2 (یک ناحیه ی 54.4 K) مشاهده می شود. این شکستگی منجر به ایجاد رونوشت e1a2 شده و پروتئین p190BCR-ABL1 تولید می گردد. سومین منطقه ای که دچار شکستگی می شود منجر به تولید یک پروتئین 230 KDa به نام p230BCR شده که در لوکمی نوتروفیلی مزمن (chronic neutrophilic leukemia) یافت می گردد.
ABL1 با فعالیت کینازی تنها زمانی که در سلول های بنیادی هماتوپویتیک (HSC) با ویژگی خود-نوزایی (self-renewal) بیان شود، لوکموژنیک (leukemogenic) می باشد. در نتیجه منجر به تبدیل HSC به LSC (leukemia Stem Cell) خواهد شد. در CML مرحله CP (CML-CP)، سلول های LSC قادر به تولید تعداد زیادی از سلول های پیش ساز اولیه لوسمی یا LPS (leukemia early progenitor cells)، LCMP (leukemia common myeloid) و LGMP (leukemia granulocyte/macrophage) هستند. این سلول های قدرت خود نوزایی نداشته و به سلول های بالغ تمایز پیدا می کنند.
ساختار و نحوه خود تنظیمی پروتئین BCR-ABL1
پروتئین BCR-ABL1 با فعالیت کینازی دارای یکسری دومین های مجزای عملکردی است. بخش N-ترمینال BCR-ABL1 از ناحیه ای به نام cap تشکیل شده که در دو ایزوفورم تولید شده از طریق پیرایش متناوب اولین اگزون (1a و 1b) حضور دارد. ABL 1b دارای یک C14 myristoyl moiety است که به صورت کووالان به ناحیه N-ترمینال متصل شده و میزان بیان آن بسیار بیشتر از نوع 1a می باشد. ABL1 همچنین دارای یک دومین تیروزین کینازی است که پیش از توالی های حفاظت شده SH2 (Src-homology-2) و SH3 قرار گرفته است. آخرین اگزون دارای دارای موتیف SH3 غنی از پرولین است که به عنوان جایگاه اتصال برای دومین های SH3 پروتئین های آداپتور مانند GRB2، CrK و Nck عمل می کند.
پروتئین BCR دارای دومین های مختلفی از جمله coiled-coil، سرین/ترئونین کینازی، Dbl/CDC24 guanine-nucleotide exchange factor homology domain، pleckstrin homology domain، جایگاه اتصال لیپیدی وابسته به کلسیم (putative calcium-dependent lipid binding site) و دومین Ras-related C3 botulinum toxin substrate (RAC) guanosine triphosphatase–activating protein می باشد. تیروزین 177 در پروتئین BCR به عنوان محل داکینگ (docking site) برای پروتئین های مختلفی از جمله GRB2، GRB10 و ABL1 از طریق دومین SH2 می باشد.
مدیفیکاسیون مریستول (myristoyl modification) در بخش انتهایی N-ترمینال ABL1b، دومین کاتالیتیک ABL1 در سمت C- ترمینال را درگیر می کند. این امر موجب تسهیل داکینگ دومین های SH2 و SH3 به دومین کینازی می گردد. انواعی از ABL1b که فاقد گروه های مریستولی هستند، فعالیت تایروزین کینازی را بروز می دهند.
در فرم غیرفعال دومین تایروزین کیناز، یک α-helix (helix αC) در سمت N-ترمینال کیناز به داخل جایگاه فعال جابه جا شده است. در این کانفورماسیون چرخش α-helix منجر به جا به جایی آمینواسیدهای مهم در جایگاه فعال می شود که این امر دسترسی ATP و سوبستراهای پپتیدی به محل جایگاه فعال را مختل میکند.
بیان BCR-ABL1
بیان و فعالیت مستمر BCR-ABL1 کیناز نه تنها عامل بقای سرطان CML می باشد بلکه در پیشرفت بیماری نیز از اهمیت بالایی برخوردار است. در شرایط آزمایشگاهی (In vitro)، BCR-ABL1 به طور مستقیم فاکتورهای رشد وابسته، کلونی زایی (clonogenicity)، حفاظت در مقابل آپوپتوز و تحرک (motility) را به شکل وابسته به دوز تنظیم می کند. در بیماران مبتلا به CML، سطح m.RNA BCR-ABL1 در فاز BP بسیار بالاتر از سطح CP است. یکی از فرضیه های مطرح در این زمینه این است که آنکوپروتئین BCR-ABL1 بیان رونوشتهای BCR-ABL1 را تقویت کرده و یا اینکه تخریب رونوشت های BCR-ABL1 را کاهش می دهد.
علی رغم اهمیت بالای بیان ABL1، مکانیسم های مستقل از BCR-ABL1 نیز ممکن است نقش مهمی در پیشرفت CML بازی کنند. به عنوان مثال، بیان بیش از حد و یا فعالسازی SFKs، HCK، LYN و FYN با پیشرفت CML و مقاومت فرد مبتلا به داروی imatinib مرتبط است. فعال سازی LYN مستقل از BCR-ABL1 در بروز مقاوت به داروی imatinib در بیمارانی که BCR-ABL1 جهش یافته را بیان می کنند، مشاهده شده است. بنابراین، استفاده از روش درمانی anti-SFK در CML فاز پیشرفته مناسب می باشد.
غیرفعال سازی ژن های سرکوبگر تومور (Tumor suppressor genes)
یکی از جهش های متداول مرتبط با پیشرفت بیماری CML، جهش در ژن p53 است. این جهش در حدود 25 تا 30 درصد از بیماران مبتلا به فاز BP مشاهده می شود. علاوه بر این، اگزون شماره 2 از لوکوس INK4A/ARF در حدود بیش از 50% مبتلایان CML در فاز BP دچار حذف شده است. این جهش ها در نهایت منجر به عدم بیان ژن هایی نظیر p16 و p14/ARF می گردد. این ژن ها در تنظیم نقطه بازرسی (checkpoint) G1/S از طریق مهار G1-phase cyclin D-Cdk4/Cdk6 و کاهش بیان p53 دخیلند.
ژن ARF عامل افزایش بیان p53 از طریق تداخل در عملکرد MDM2 است و جهش های حذفی هموزیگوت در لوکوس p16/ARF ممکن است معادل عملکردی جهش p53 در BP میلوئیدی باشد. یکی از داروهای موثر در بحث درمان بیماری CML، استفاده از داروی imatinib است که مسیر سیگنالینگ p53 نقش مهمی در پاسخ دهی این دارو دارد. استفاده از داروی imatinib در درمان سلول هایی که BCR-ABL1 را بیان می کنند، منجر به فعال سازی انتخابی ژن p53 به دلیل مهار BCR-ABL1 کیناز می گردد. در مقابل، غیرفعال ژن p53 با پیشرفت بیماری CML، عدم پاسخ دهی به داروی imatinib بدون جلوگیری از مهار BCR-ABL1 کیناز همراه است. بنابراین، جهش هایی که بر مسیر سیگنالینگ p53 تاثیر می گذارند ممکن است در مقاومت به داروی imatinib موثر باشند.
خانواده RUNX از فاکتورهای رونویسی نیز در پاسخ به imatinib و تداوم بیماری در بیماران مبتلا به CML نقش دارند. از سوی دیگر، PP2A (serine/threonine phosphatase 2A) به عنوان یک سرکوبگر تومور از طریق مقابله (antagonizing) با BCR-ABL1 عمل می کند. کیناز BCR-ABL1 از طریق up-regulating پروتئین SET (فسفوپروتئین مهارکننده PP2A) منجر به مهار PP2A می گردد. سپس PP2A منجر به فعال شدن پروتئین تایروزین فسفاتاز 1 (SHP1) می شود که این پروتئین کاتالیز کننده دفسفریلاسیون BCR-ABL1 و تخریب پروتئوزومال آن می باشد. بنابراین هم فعال شدن PP2A و هم غیرعال شدن SET از جمله استراتژی های کاربردی در بحث درمان بیماری CML می باشند. خاموش کردن(silencing) SET با استفاده از siRNA و یا درمان سلول های BCR-ABL1 مثبت با forskolin (فعال کننده PP2A) منجر به کاهش بیان BCR-ABL1 می گردد.
Fingolimod (FTY720) ، از دیگر فاکتورهای فعال کننده PP2A است که در سرکوب سیستم ایمنی در افراد مبتلا به بیماری MS مورد استفاده قرار می گیرد. این فاکتور القا کننده آپوپتوز وابسته به کاسپاز و عامل ایجاد اختلال در و پتانسیل کلونوژنیک در رده سلولی مقاوم به داروهای imatinib و dasatinib به نام 32D-p210(T315I)BCR-ABL1 است.
روش های تشخیص بیماری CML
امروزه جهت تشخیص بیماری CML از روش های مختلفی استفاده می شود که برخی از آنها عبارتند از:
• آزمایش خون
عموما اولین روشی که جهت تشخیص بیماری CML استفاده می شود، آزمایش شمارش کامل خون یا CBC است که به شمارش سلول های موجود در نمونه خون می پردازد. بیماران مبتلا به CML سطح بالایی از گلبول های سفید خون را نشان می دهند البته ممکن است که این امر ناشی از دیگر بیماری ها هم باشد. در سطوح پیشرفته این نوع سرطان، ممکن است سطوح پایین گلبول های قرمز خون نیز مشاهده گردد.
• بیوپسی و آسپیراسیون مغز استخوان
این دو روش تقریبا تکنیک های مشابهی جهت جمع آوری نمونه از بافت مغز استخوان فرد بیمار هستند. به طور کلی، مغز استخوان از دو نوع بافت جامد و مایع تشکیل شده است. در تکنیک آسپیراسیون با استفاده از سوزن مقداری از بخش مایع مغز استخوان برداشته می شود. اما در روش بیوپسی از بافت جامد مغز استخوان نمونه جهت بررسی های دقیق آزمایشگاهی برداشته خواهد شد.
• تست های تصویر برداری
روش هایی مانند اشعه ایکس و سی تی اسکن از جمله روش های متداول در بررسی اندام ها و تومورهای داخلی بدن هستند که به پزشک در تشخیص بیماری و تعیین دقیق موقعیت تومور کمک میکنند.
• تست های ملکولی
سیتوژنتیک یکی از تست های ملکولی مورد استفاده در بحث تشخیص بیماری CML است. این تکنیک به آنالیز تعداد کروموزوم ها و ویژگی های ظاهری آنها می پردازد. بهترین نمونه جهت آزمایش سیتوژنتیک، استفاده از مغز استخوان فرد بیمار می باشد که سلول های خونی نابالغ به طور فعال در حال تقسیم هستند.
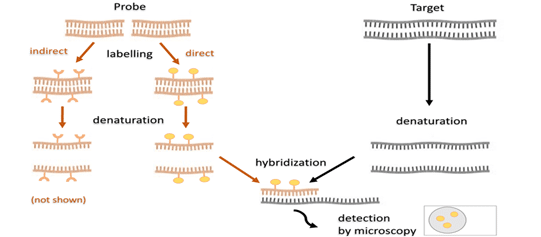
تکنیک FISH (Fluorescent In Situ Hybridization)، از روش های کارآمد در زمینه تشخیص t(9;22) و بازآرایی BCR-ABL1 و نظارت بر روند درمان بیماری است. این روش قادر است با حساسیت بالایی به تشخیص کروموزوم فیلادلفیا در نمونه خون فرد بیمار (نمونه خون یا مغز استخوان) بپردازد. FISH یک تکنیک سیتوژنتیکی است که در اوایل دهه 1980 توسعه یافت. در این روش از پروب های فلورسنت به منظور هدف قرار دادن مکان های کروموزومی خاص در هسته استفاده می کند که در نتیجه سیگنال های رنگی را می توان با استفاده از میکروسکوپ فلورسنت تشخیص داد. در مقایسه با تجزیه و تحلیل کاریوتیپ معمولی، روش FISH نیازی به کشت سلولی نداشته و میتواند مستقیماً از هسته های اینترفاز جاسازی شده مورد استفاده قرار گیرد. با کشف ژنهای متعدد مرتبط با بیماری در سالهای اخیر، کاربرد FISH گسترش یافته و در تشخیص بیماری های ژنتیکی، بدخیمی های خونی و تومورهای جامد به کار می رود. تکنیک FISH همچنین می تواند برای تشخیص بازآرایی BCR-ABL در مواردی از بیماران CML که BCR-ABL آنها مثبت است اما Ph منفی هستند مورد استفاده قرار گیرد.
• Real-Time PCR
یکی از تکنیک های موثر در تشخیص بیماری CML، روش کمی Real-Time PCR است که در تشخیص جهش های مرتبط با CML و نظارت بر روند درمان مورد استفاده قرار می گیرد. واکنش Real-Time PCR یا تکنیک PCR کمی (Quantitative PCR or qPCR)، نوعی Multiplex PCR است که امکان مانتیور کردن و مشاهده پیشرفت واکنش را حین تکثیر برای کاربر فراهم می کند. از مزایای این روش می توان به سرعت و دقت و حساسیت بالای آن اشاره کرد که باعث شده ابزاری کلیدی در تشخیص بیماری ها بشمار رود.
روش Real-Time PCR به منظور تعیین کمی m.RNA سنتز شده توسط ژن BCR-ABL در خون بیماران مبتلا به CML به یکی از تکنیک های ملکولی اصلی در تشخیص این نوع سرطان خون تبدیل شده است. در حدود 95% از بیماران مبتلا به CML ژن BCR-ABL بیان می گردد که به همین علت می توان به کمک این نوع روش PCR با دقت و حساسیت بالایی بیماری را تشخیص داد.
یک مسأله مهم در خصوص Real-Time PCR این است که مقدار نمونه DNA اولیه در sample تعیین کننده تعداد آمپلیکون ها در واکنش PCR می باشد. یکی از کاربردهای مهم این تکنیک در زمینه بررسی بیان ژن هاست که در آن ابتدا mRNA توسط آنزیم Reverse Transcriptase به cDNA تبدیل شده و در مرحله بعد cDNA به عنوان template برای واکنش Real-time PCR خواهد بود که با کمک پروب های نشان دار و پرایمرها به تکثیر قطعه مدنظر پرداخته می شود. این پروب ها به گونه ای طراحی شده اند که میزان نور ساتع شده از آنها نشان دهنده پیشرفت مراحل واکنش و تولید محصول می باشد. در تکنیک Real-Time PCR اصطلاحی به نام Ct یا چرخه آستانه وجود دارد که به اولین چرخه ای که میزان نور فلورسنت تولیدی آن بالاتر از فاز اولیه باشد گفته می شود.
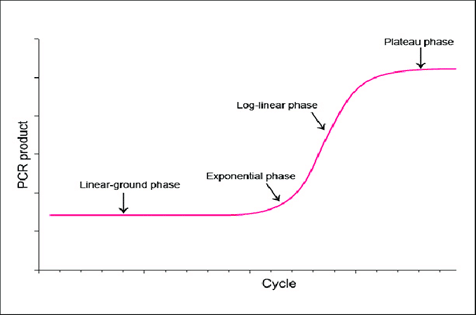
نتایج Real-Time PCR به شکل گراف هایی به شکل همزمان با پیشرفت روند واکنش نشان داده می شوند که این گراف ها نشان دهنده 4 فاز اصلی واکنش هستند. فازهای مختلف عبارتند از:
• فاز اول یا Linear ground phase: در این مرحله قطعات به سرعت در حال سنتز هستند اما سیگنال به اندازه ای قوی نیست که توسط دستگاه تشخیص داده شود.
• فاز دوم یا Early exponential phase: در این فاز تکثیر به شکل تصاعدی انجام شده و دستگاه سیگنال ها را دریافت می کند.
• فاز سوم یا Log-linear phase: در این فاز به تدریج سرعت واکنش Real-Time PCR به تدریج کاهش یافته و مواد واکنش و کارایی آنها در حالت کاهش می باشد.
• فاز چهارم یا Plateau phase: در فاز چهارم دیگر تغییری در سطح نور فلورسنت دریافتی توسط دستگاه تشخیص داده نمی شود که نشان دهنده از بین رفتن ترکیبات موجود در واکنش می باشد.
روش های درمان CML
تا امروز 4 دارو که تائیدیه FDA را دریافت کرده اند، در زمینه درمان بیماری CML مورد استفاده قرار می گیرند. اساس کار این داروها مهار تیروزین کیناز است که شامل imatinib نسل اول، dasatinib، nilotinib و bosutinib نسل دوم می باشد. در صورتی که بیماری CML در مرحله chronic phase باشد مهار کننده های تایروزین کیناز نسل دوم که شامل dasatinib، nilotinib و bosutinib است، برای درمان تجویز خواهد شد.
imatinib اولین TKI بود که توسط سازمان غذا و دارو (FDA) برای درمان بیماران مبتلا به CML-CP تأیید شد. مکانیسم عملکرد این دارو از طریق مهار رقابتی در محل اتصال ATP انکوپروتئین BCR-ABL1 است که منجر به مهار فسفوریلاسیون پروتئین های دخیل در انتقال سیگنال سلولی می گردد. imatinib به طور موثر BCR-ABL1 کیناز را مهار کرده و همچنین گیرنده فاکتور رشد مشتق از پلاکت (PGDFR) و تیروزین کیناز C-KIT را مسدود می کند.
Dasatinib یک TKI خوراکی نسل دوم است که عملکرد آن در شرایط آزمایشگاهی حدود 350 برابر قوی تر از imatinib می باشد. این دارو همچنین قادر است خانواده کینازهای Src را که ممکن است در کاهش مسیرهای سیگنالینگ سلولی مهم باشد، مهار می کند. از سوی دیگر، Nilotinib آنالوگ ساختاری imatinib می باشد. تمایل آن به محل اتصال ATP در BCR-ABL1 حدو 30 تا 50 برابر بیشتر از imatinib در شرایط آزمایشگاهی است. Bosutinib نیز یک مهارکننده دوگانه SRC/ABL کیناز است. این دارو ابتدا با 500 میلی گرم در روز برای درمان CML-CP به دنبال مقاومت و یا عدم تحمل به درمان قبلی TKI تایید گردید.
Ponatinib، یک مهار کننده تایروزین کیناز نسل سوم است که در درمان بیماران CML که در مرحله chronic phase هستند تجویز می گردد. این بیماران اغلب نسبت به سایر داروها پاسخی نشان نداده اند و در برخی موارد دارای جهش T315I می باشند. زمانی که سرطان CML پیشرفت کرده و وارد accelerated یا blast phaseمی شود باید از سایر روش های درمانی نیز جهت کنترل بیماری استفاده شود.
منابع علمی
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4922205
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3952549
https://www.ncbi.nlm.nih.gov/books/NBK531459
https://jnccn.org/view/journals/jnccn/18/10/article-p1385.xml?ArticleBodyColorStyles=inline%20pdf
https://www.ncbi.nlm.nih.gov/gene/25
https://www.ncbi.nlm.nih.gov/gene/613#gene-expression
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6172424

