ویروس HPV چیست؟
ویروس های پاپیلومای انسانی یا ویروس HPV (Human papilloma virus) یکی از علل اصلی بروز بیماری های اپیتلیوم پوست و مخاطی مانند زگیل های تناسلی و سرطان دهانه رحم می باشد. این ویروس یکی از شایع ترین ویروس هایی است که از راه رابطه جنسی کنترل نشده با فرد آلوده منتقل می گردد و هم در زنان و هم مردان مشاهده می شود. در سال های اخیر، سرطان دهانه رحم به عنوان شایع ترین سرطان زنان و اصلی ترین علت مرگ و میر زنان جوان گزارش شده است که میزان شیوع آن در کشورهای مختلف جهان متفاوت می باشد اما به نسبت در کشورهای غربی متداول تر می باشد.
در کشورهای در حال توسعه، سرطان دهانه رحم اغلب شایع ترین سرطان در زنان است و ممکن است تا 25 درصد از کل سرطان های زنان را تشکیل دهد. بر اساس آمارهای سازمان بهداشت جهانی (WHO) سالانه حدود 500000 هزار مورد جدید ابتلا به این ویروس در جهان ثبت می شود که 250000 مورد از آنها کشنده هستند. از سوی دیگر، بر اساس آخرین گزارش ها نرخ شیوع این بیماری در زنان بسیار بیشتر از مردان است و زنان دوبرابر مردان در معرض خطر ابتلا به این عفونت قرار دارند.
انواع ویروس HPV
تا امروز بیش از 120 سویه از ویروس HPV شناخته و توالی آنها شناسایی شده است. این ویروس از لحاظ فیلوژنتیکی به دو گروه α-HPV و -HPVβ طبقه بندی می گردد که به ترتیب با عفونت های مخاطی و پوستی مرتبطند. انواع ویروس پاپیلومای انسانی بر اساس توانایی سرطان زایی به دو گروه کم خطر (Low risk) و پر خطر (High risk) طبقه بندی می گردند که انواع کم خطر مرتبط با بروز زگیل و انواع پرخطر مرتبط با بروز سرطان هایی نظیر دهانه رحم، مقعد و سرطان های سر و گردن هستند.
انواع پرخطر شامل سویه های 16، 18، 31، 33، 35، 39، 45، 51، 52، 56، 58، 59، 66 و 68 می باشد که سویه های 16 و 18 عامل بسیاری از سرطان های مرنبط با این ویروس است. از سویه های کم خطر ویروس HPV می توان به سویه های 6، 11، 42، 43 و 44 اشاره کرد که در ایجاد ضایعات داخل اپیتلیال سنگفرشی (SILs)دخیلند.
ساختار ویروس HPV
1) اجزای ویروسی و خواص فیزیکی
به طور کلی، ویروس HPV یک ویروس کوچک (حدودا 55 نانومتر) و بدون پوشش است که ماده ژنتیک آن DNA دو رشته ای حلقوی با طول تقریبی 8 kb می باشد. ماده ژنتیک این ویروس به هیستون های سلولی متصل شده و درون یک کپسید پروتئینی متشکل از 72 کپسومر پنتامر قرار گرفته است. کپسید دارای دو پروتئین ساختاری به نام های L1 (55 kDa که 80% از پروتئین های سلولی را تشکیل می دهد) و L2 (70 kDa) است که توسط ژنوم ویروس کد می شوند. اجزای شبه ویروسی یا VLPs (Virus-Like particles) می توانند یا فقط با بیان L1 و یا به همراه L2 در سیستم های بیانی پستانداران یا غیر پستانداران تولید شوند.
2) ژنوم ویروس HPV، پروتئین ها و چرخه سلولی
در ژنوم ویروس HPV حدود 8 عدد ORF وجود دارد که همه آنها از یک رشته DNA رونویسی شده اند. ORF ویروس به سه بخش عملکردی مختلف تقسیم بندی می گردد که عبارتند از:
• ناحیه E:
شامل ژن هی مختلف کد کننده early viral function می باشد که عبارتند از:
ژن های E1/E2 پروتئین هایی را کد می کنند که در تنظیم عملکرد ژن های E6 و E7 ودخیل بوده و به عنوان فاکتورهایی عمل می کنند که نقش آنها شناسایی نقطه شروع رونویسی می باشد.
ژن E4 کد کننده پروتئینی با عملکرد تقریبا ناشناخته است که احتمالا در انتشار ویروس از سلول دخیل می باشد.
E5 gene پروتئین های آبگریزی را کد می کند که در نامیرایی سلول نقش دارند.
E6 ژن کد کننده پروتئین های دخیل در مهار تنظیم کننده های منفی چرخه سلول است و از سوی دیگر ژن P53 نیز که در القای مسیر آپوپتوز دخالت دارد توسط این ژن مهار می گردد.
E7 پروتئین هایی را کد می کند که به پروتئین های کد شده تویط ژن سرکوبگر تومور Rb متصل شده و باعث مهار آن می شوند.
• ناحیه L:
شامل ژن L1/L2 است که کد کننده late viral function هستند و در تشکیل کامل اجزای ویروسی دخالت دارند.
• ناحیه LCR:
یک ناحیه کنترل بلند (Long Control Region) است که بین نواحی E و L واقع شده است و هیچ پروتئینی را کد نمی کند.
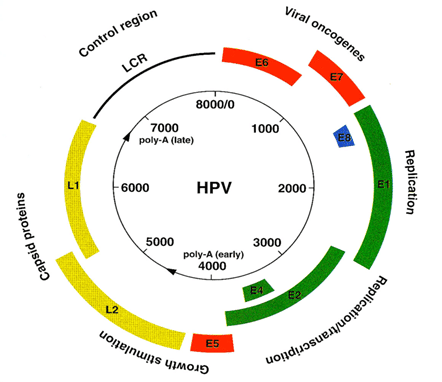
رونویسی پروتئین های E ویروسی از پروموتر اولیه (مانند P97 در HPV 31) صورت می گیرد در حالی که پروتئین های L عمدتاً از پروموتر متأخر رونویسی می شوند (P742 در HPV 31). ویروس های پاپیلومای انسانی از نوع epitheliotropic بوده و به شدت بخش اپیتلیال پوست در نواحی مختلفی مانند حفره دهان و دستگاه تناسلی را درگیر می کند. چرخه حیات این ویروس با تمایز سلول های اپیتلیال آلوده مرتبط می باشد.
تثبیت ژنوم ویروس HPV در سلول های بازال Basal cells)) متکی به ژن های مختلفی از جمله E1، E2، E6 و E7 است. در حالت نرمال، زمانی که Basal cells تقسیم می شود سلول های دختری تماس خود را با غشای پایه از دست داده و وارد suprabasal compartment می گردد، از چرخه سلولی خارج می شود و برنامه تمایز نهایی را آغاز می کند. با این حال، کرانوسیت ها و سلول های اپیتلیال دهانه رحم (cervical epithelial cells) که به عفونت HPV دچار شده اند، سلول های suprabasal نمی توانند از چرخه سلولی خارج شده و به تکثیر DNA ادامه می دهد. علاوه بر این، آنکوپروتئین E5 هم در خصوص سویه HPV16 و هم HPV31 به طور کمی به این ویژگی کمک می کند. در suprabasal compartment سلول ها باعث تقویت تکثیر ژنوم ویروسی و بیان ژن های کپسید می شوند.
پروتئین های E6 و E7 دو پروتئین اصلی در مسیر سرطان زایی ویروس HPV هستند که از طریق اتصال به ژن های سرکوبگر تومور (Tumor suppressor genes) منجر به غیر فعال کردن آنها و اختلال در چرخه سلولی میزبان می شوند. امروزه با روش های مختلفی از جمله Real-Time PCR و استفاده از رنگ های فلورسنت می توان وجود این ویروس را در افراد تشخیص داد.
بیماری های مرتبط با ویروس HPV
نتایج مطالعات مختلف نشان می دهد که ویروس HPV با ابتلا به طیف وسیعی از بیماری ها از جمله زگیل های تناسلی و ناحیه دهان، سرطان دهانه رحم، مقعد و سر و گردن مرتبط است که در اکثر موارد افراد به انواع کم خطر یا خوش خیم (benign) آن مبتلا می شوند. سویه های کم خطر به خصوص انواع 6 و 11 عامل ایجاد زگیل های تناسلی در مبتلایان هستند که اغلب در نواحی مختلفی مانند واژن، دهانه رحم، کشاله ران، مقعد، آلت تناسلی، لب و دهان مشاهده می شوند. زگیل ها نواحی هایپرتروفی شده پوست هستند که توسط کراتین پر می گردند. اغلب سویه های کم خطر پس از چند سال توسط سیستم ایمنی بدن از بین می روند. در جدول زیر برخی از بیماری ها و ویروس های HPV مرتبط با آنها ذکر شده است.
| سویه ویروس HPV مرتبط با بیماری | نوع بیماری | ||
| سویه های 2، 4 و 7 و گاهی انواع 75 و 77 |
|
||
| سویه های 3، 10 و گاهی 26، 29 و 41 |
|
||
| سویه های 1، 2 و 4 |
|
||
| سویه های 3 و 10 |
|
||
| سویه های 5 و 8 و انواع 9، 12، 14، 15، 17، 19، 20، 21 تا 25، 36 تا 39، 47 و 49 با شیوع کمتر |
|
||
| سویه های 5، 8 و انواع 14، 17، 20 و 47 با شیوع کمتر |
|
||
| سویه های 6، 11، 40، 42، 43، 44، 54، 61، 72، 81، 89 |
|
||
| سویه 6 |
|
||
| سویه های 16 و 55 |
|
||
| سویه های 16، 18، 31، 33، 45، 51 و 52 |
|
||
| سویه 68 |
|
||
| سویه های 26، 53، 64، 65، 66، 67، 69، 70، 73 و 82 |
|
||
| سویه های 2، 6، 7، 11، 16، 18، 32 و 57 |
|
||
| سویه های 6 و 11 |
|
||
| سویه های 13 و 32 |
|
||
| سویه های 16 و 18 |
|
سرطان های مرتبط با ویروس HPV
پس از سرطان پوست و سرطان سینه، سرطان دهانه رحم (Cervical cancer) شایع ترین سرطان در میان زنان ایالت متحده می باشد اما در کشورهای در حال توسعه این بیماری شایع ترین نوع سرطان در زنان است و حدود 25% از کل موارد ابتلا به سرطان را به خود اختصاص داده است. تقریبا عامل همه موارد ابتلا به سرطان دهانه رحم، سویه های پرخطر (High risk) ویروس HPV است که بر اساس آمارهای سازمان بهداشت جهانی (WHO) غربالگری و واکسیناسیون بهترین روش جلوگیری از ابتلا به این بیماری می باشد.
سرطان دهانه رحم اغلب از محل اتصال سلول های سنگفرشی (squamous cells) اکتوسرویکس (ectocervix)، columnar و سلول های غده ای از کانال اندوسرویکال (glandular cells of the endocervical canal) آغاز می شود. در ابتدا ابتلا فرد به عفونت HPV، تغییرات متاپلاستیک (Metaplastic changes) در این ناحیه شروع شده و خطر بروز سرطان دهانه رحم در آینده افزایش می یابد. حدود 80% تا 90% از سرطان های دهانه رحم کارسینوم سلول سنگفرشی (SCC) (squamous cell carcinomas) و 10-20% از موارد ابتلا آدنوکارسینوما هستند که درصد آن در سالهای اخیر افزایش یافته است.
در برخی موارد هر دو نوع از این سلول های دچار تغییرات سرطانی می شوند که به آنها Aden squamous or mixed carcinomas اطلاق می گردد. در خصوص سرطان دهانه رحم SCC ممکن است که در مراحل اولیه فاقد علائم خاصی باشد اما با پیشرفت بیماری ترشحات غیر طبیعی واژن، درد در ناحیه لگن، خونریزی و درد در حین مقاربت مشاهده می شود. بر اساس نتایج آمارها، HPV 16 عامل 50% و HPV 16 و HPV 18 علت بروز بیش از 70% سرطان دهان رحم هستند.
پیش از تائید بروز بدخیمی در ناحیه دهانه رحم، نوعی نئوپلازی به نام Cervical intraepithelial neoplasia یا به اختصار CIN مشاهده می شود که نوعی بیماری پیش سرطانی است که در آن سلول های غیر طبیعی بر روی سطح دهانه رحم رشد می کنند.
مراحل مختلف سرطان دهانه رحم
دیسپلازی دهانه رحم بر اساس میزان خطر سرطانی شدن این سلول ها به سه گروه مختلف طبقه بندی می شوند که عبارتند از:
• CIN 1 : در این گروه سلول های غیر نرمال تنها یک سوم از ضخامت لایه اپیتلیال را تحت تاثیر خود قرار داده اند. در این حالت به ندرت سلول های غیر نرمال سرطانی خواهند شد و در برخی موارد از بین می روند.
• CIN 2 : در این مرحله حدود یک سوم تا دو سوم از لایه اپیتلیال تحت تاثیر سلول های غیرنرمال قرار گرفته است.
• CIN 3 : در این مرحله بیش از دو سوم لایه اپیتلیال تحت تاثیر سول های غیر نرمال قرار گرفته است. در مرحله CIN 2 و CIN 3 فرد نیاز به پیگیری بیماری و دریافت درمان های مناسب جهت جلوگیری از سرطانی شدن خواهد داشت.
روش های تشخیص عفونت HPV
با کمک روش های مختلفی می توان وجود ویروس HPV را در افراد مختلف تشخیص داد که در ادامه به معرفی آنها پرداخته می شود.
1) پاپ اسمیر
یکی از متداول ترین روش ها جهت تشخیص به موقع سرطان دهانه رحم، انجام آزمایش پاپ اسمیر یا تست پاپ می باشد. این روش شامل نمونه برداری از سلول های رحم و دهانه رحم با کمک یک براش می باشد. توصیه می شود خانم های متاهل بالای 21 سال، هر سه سال یکبار این آزمایش را انجام دهند.
2) کولپوسکپی و بیوپسی
کولپوسکپی یکی از روش های متداول معاینه سلول های رحم از طریق نوعی میکروسکپ خاص به نام کولپوسکپ (colposcope) است. این تست اغلب به افرادی توصیه می شود که نتیجه پاپ اسمیر آنها غیرنرمال باشد. در زمان انجام این آزمایش در صورتی که پزشک سلول های غیر عادی را مشاهده کند از آنها نمونه برداری یا بیوپسی انجام می دهد. بیوپسی در مرحله بعد جهت آزمایشات دقیق تر به آزمایشگاه ارسال می گردد.
3) تست ملکولی ویروس HPV
جهت تشخیص ملکولی ویروس HPV از روش های مختلفی استفاده می شود که یکی از آنها Real-Time PCR می باشد. این روش از جمله روش های بسیار دقیق و قابل اعتماد در زمینه تشخیص است که با کمک آن می تواند ژنوتیپ های مختلف ویروس را پس از استخراج DNA از نمونه پاپ اسمیر یا هر بافت ناحیه تناسلی شناسایی کرد. از جمله مزایایی این ویروس می توان به امکان تعیین Viral load، نیاز به مقادیر کم نمونه اولیه و مشخص کرد، نوع سویه HPV در فرد اشاره کرد. افرادی که آزمایش پاپ اسمیر را به همراه تست HPV انجام می دهند (co-testing) توصیه می شود که هر 5 سال یکبار این تست را تکرار کنند تا در صورت وجود عفونت، بتوان به تشخیص به موقع بیماری و درمان پرداخت.
واکنش Real-Time PCR یا تکنیک PCR کمی (Quantitative PCR or qPCR)، نوعی Multiplex PCR است که امکان مانتیور کردن و مشاهده پیشرفت واکنش را برای کاربر فراهم می کند. از مزایای این روش می توان به سرعت و دقت و حساسیت بالای آن اشاره کرد که باعث شده ابزاری کلیدی در تشخیص بیماری ها بشمار رود.
یک مسأله مهم در خصوص Real-Time PCR این است که مقدار نمونه DNA اولیه در sample تعیین کننده تعداد آمپلیکون ها در واکنش PCR می باشد. یکی از کاربردهای مهم این تکنیک در زمینه بررسی بیان ژن هاست که در آن ابتدا mRNA توسط آنزیم Reverse Transcriptase به cDNA تبدیل شده و در مرحله بعد cDNA به عنوان template برای واکنش Real-time PCR خواهد بود که با کمک پروب های نشان دار و پرایمرها به تکثیر قطعه مدنظر پرداخته می شود. این پروب ها به گونه ای طراحی شده اند که میزان نور ساتع شده از آنها نشان دهنده پیشرفت مراحل واکنش و تولید محصول می باشد. در تکنیک Real-Time PCR اصطلاحی به نام Ct یا چرخه آستانه وجود دارد که به اولین چرخه ای که میزان نور فلورسنت تولیدی آن بالاتر از فاز اولیه باشد گفته می شود.
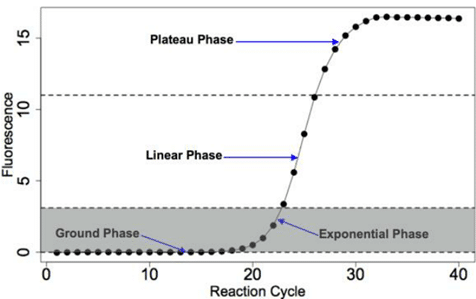
نتایج Real-Time PCR به شکل گراف هایی به شکل همزمان با پیشرفت روند واکنش نشان داده می شوند که این گراف ها نشان دهنده 4 فاز اصلی واکنش هستند. فازهای مختلف عبارتند از:
• Linear ground (فاز اول): در این مرحله قطعات به سرعت در حال سنتز هستند اما سیگنال به اندازه ای قوی نیست که توسط دستگاه تشخیص داده شود.
• Early exponential (فاز دوم): در این فاز تکثیر به شکل تصاعدی انجام شده و دستگاه سیگنال ها را دریافت می کند.
• Log-linear (فاز سوم): در این فاز به تدریج سرعت واکنش Real-Time PCR به تدریج کاهش یافته و مواد واکنش و کارایی آنها در حالت کاهش می باشد.
• Plateau (فاز چهارم): در فاز چهارم دیگر تغییری در سطح نور فلورسنت دریافتی توسط دستگاه تشخیص داده نمی شود. علت این امر از بین رفتن ترکیبات موجود در واکنش می باشد.
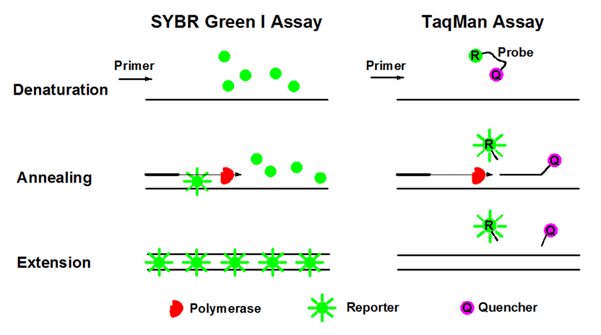
انواع رنگ های فلورسنت Real-Time PCR
در تکنیک Real-Time PCR به طور کلی از دو گروه رنگ های فلورسنت استفاده می شود. در گروه اول از رنگ های فلورسنت متصل شونده به DNA دو رشته ای مانند سایبرگرین (SYBR Green) و اواگرین (EvaGreen) استفاده می گردد. این رنگ ها قادرند به هر DNA دو رشته ای در محیط واکنش به شکل غیر اختصاصی متصل شوند. در گروه دوم رنگ های فلورسنت به توالی های الیگونوکلئوتیدی به نام پروب متصل هستند. این دسته های از رنگ های فلورسنت تنهاقادرند که به توالی های خاصی متصل شوند که شامل پروب های هیدورلیزی مانند پروب TaqMan و beacons می باشد.
محصول Trita® r-HPV Detection Kit ، 14 سویه پرخطر ویروس High risk HPV را با کمک روش Real-Time PCR و 4 رنگ فلورسنت مختلف (FAM, Cy5, HEX و ROX) در 4 کانال رنگی مجزا تشخیص داده می شود. ژنوتیپ های مورد بررسی توسط این کیت شامل انواع 16، 18، 31، 33، 35، 39، 45، 51، 52، 56، 58، 59، 66 و 68 می باشد.
منابع علمی
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC145302
https://virologyj.biomedcentral.com/articles/10.1186/1743-422X-8-269
https://www.mdpi.com/1422-0067/23/9/4943
https://www.ncbi.nlm.nih.gov/books/NBK321770
https://www.sciencedirect.com/science/article/pii/S0042682213003565
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3507852
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9092940
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3122643
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3139291
https://www.mdpi.com/2073-4425/13/12/2387
https://www.ncbi.nlm.nih.gov/books/NBK448132
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8278030

